Graphit, ein wichtiges Allotrop des Kohlenstoffs, spielt in vielen Bereichen eine wichtige Rolle. Die eingehende Erforschung seiner Struktur ist der Schlüssel zur Erschließung des breiten Anwendungspotenzials von Graphit und zur Entwicklung neuer Materialien.
Inhaltsübersicht
Umschalten auf
Was ist Graphit?
Graphit, ein aus Kohlenstoffatomen bestehendes Mineral, ist in der Natur weit verbreitet. Es hat einen metallischen Glanz und fühlt sich weich und glatt an. Das macht es zu einem idealen Material für Bleistiftminen. Die Farbe von Graphit ist meist schwarz oder dunkelgrau. Seine Reinheit und sein Kristallisationsgrad variieren je nach der Umgebung, in der er entsteht.
Atomare und molekulare Struktur von Graphit
Atomare Struktur von Graphit
Graphit besteht hauptsächlich aus Kohlenstoff. Die Kohlenstoffatome in Graphit sind durch kovalente Bindungen miteinander verbunden. Und jedes Kohlenstoffatom und die drei umgebenden Kohlenstoffatome bilden eine stabile hexagonale Ringstruktur, die sich in der Ebene unbegrenzt ausdehnt und ein festes Atomgerüst bildet.
Molekulare Struktur von Graphit
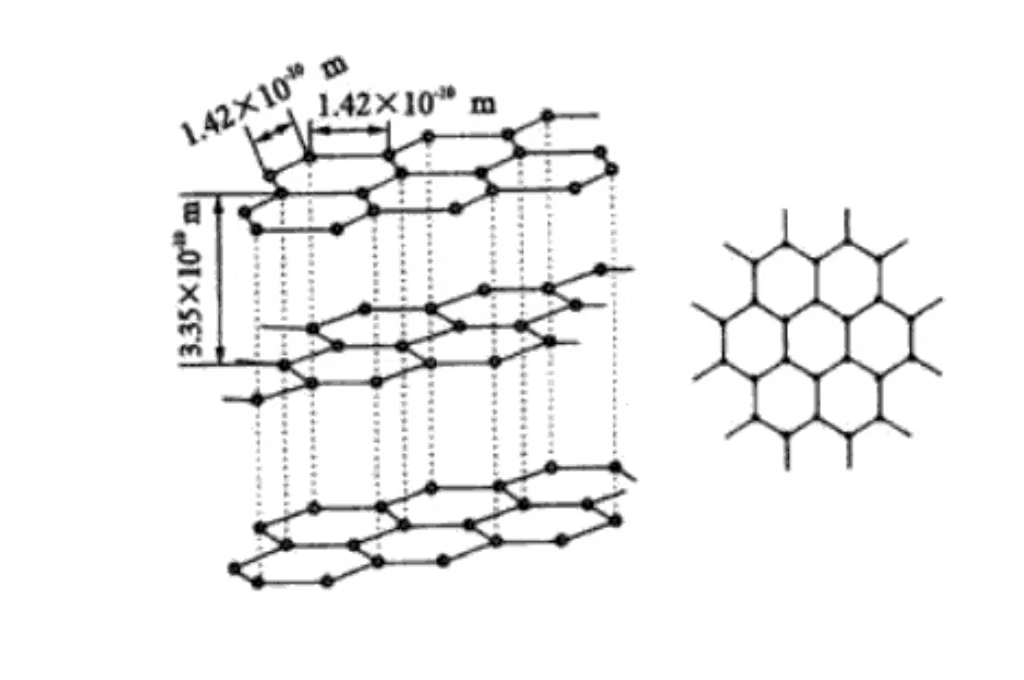
Auf molekularer Ebene setzt sich Graphit zusammen aus Schichten aus übereinander gestapelten Kohlenstoffatomen. Die Kohlenstoffatome zwischen den Schichten werden durch relativ schwache Van-der-Waals-Kräfte zusammengehalten. Und diese geschichtete Struktur erklärt, warum der Graphit ausgezeichnete Schmierfähigkeit und leichtes Gleiten zwischen den Schichten.
Zwei Schlüsselelemente der Graphitstruktur
Hexagonale Kristallstruktur von Graphit
Arrangements
Graphit hat eine hexagonale Kristallstruktur. Die Kohlenstoffatome sind eng in Sechsecken in der Ebene angeordnet, einschließlich eines Winkels von 120 Grad. Die Anordnung ist regelmäßig und stabil, förderlich für die Elektronenleitung, ist die Grundlage für seine gute elektrische Leitfähigkeit.
Schichtung
Die Kohlenstoffatome sind in parallelen Ebenen gestapelt, der Schichtabstand beträgt etwa 0,335nm. Die Van-der-Waals-Kraft zwischen den Schichten ist schwach, so dass der Graphit leicht zwischen den äußeren Schichten gleiten kann und schmierbar ist. Es wird häufig als Schmiermittel in der mechanischen Fertigung verwendet.
Schichten der Kristallstruktur
Jede Schicht aus Kohlenstoffatomen bildet durch kovalente Bindungen eine Netzebene. Diese ist in geordneter Weise im Raum angeordnet, was die makroskopischen Kristalleigenschaften und die Anisotropie von Graphit bewirkt. Die starke kovalente Bindung in den Schichten verleiht dem Graphit eine hohe Festigkeit und Härte in der Ebene. In der vertikalen Richtung der Ebene ist die Festigkeit aufgrund der schwachen Kräfte zwischen den Schichten gering.
Bindungen innerhalb der Kohlenstoffatome
Van-der-Waal-Kräfte
Die Kohlenstoffatome in den Zwischenschichten stützen sich auf die Van-der-Waals-Kraft, die schwach ist, was zu einer leichten gleitenden Trennung zwischen den Graphitschichten und zu Schmierfähigkeit führt. Dies führt jedoch auch dazu, dass die Zwischenschichtstruktur von Graphit unter bestimmten Bedingungen (z. B. hohe Temperatur und hoher Druck) veränderlich ist. So kann er beispielsweise in eine Diamantstruktur umgewandelt werden.
Trennung der Schichten
Aufgrund der schwachen van-der-Waals-Kraft kann die Graphitschicht durch Anwendung einer geringen Scherkraft getrennt werden. Dies spiegelt nicht nur die Schmierfähigkeit wider, sondern schafft auch die Möglichkeit von Einlagerungsreaktionen, durch die die physikalischen und chemischen Eigenschaften von Graphit verändert werden können, um spezielle Verbundwerkstoffe herzustellen. So zum Beispiel negative Elektrodenmaterialien für Lithium-Ionen-Batterien.
Kovalente Bindungen
Die Kohlenstoffatome in der Schicht sind durch kovalente Bindungen eng miteinander verbunden und bilden eine stabile hexagonale Struktur. Dies bestimmt die hohe Härte und Festigkeit von Graphit in der Ebene und garantiert seine strukturelle Stabilität bei der Anwendung von Elektrodenmaterialien. Außerdem wird die Bewegung der Elektronen eingeschränkt, was sich auf die Anisotropie in der Ebene auswirkt.
Sp2-Hybridisierung
Bindungswinkel
Kohlenstoffatome nehmen sp2-Hybridisierung an, ein 2s-Orbital und zwei 2p-Orbitale hybridisieren zu drei gleichwertigen sp2-Hybridisierungsorbitalen. Diese sind in einem ebenen Dreieck mit einem Winkel von etwa 120 Grad verteilt. Auf diese Weise bilden die Kohlenstoffatome stabile kovalente Bindungen mit drei benachbarten Kohlenstoffatomen, um eine hexagonale Struktur zu bilden, die die Delokalisierung von Elektronen und eine gute elektrische Leitfähigkeit begünstigt.
Kohlenstoff-Atome
Das Kohlenstoffatom bildet über sp2-Hybridorbitale ein planares Skelett mit drei umgebenden Kohlenstoffatomen. Die vertikalen Ebenen der nicht hybriden 2p-Orbitale überschneiden sich und bilden delokalisierte π-Elektronenwolken. π-Elektronenwolken verleihen Graphit eine gute elektrische Leitfähigkeit, in der sich die Elektronen als Reaktion auf Veränderungen der elektrischen Felder frei bewegen können. Dadurch wird Graphit in chemischen Reaktionen aktiv und nimmt an elektrochemischen Prozessen teil. Zum Beispiel als Elektronenübertragungsmedium in Lithium-Ionen-Batterien.
Anisotropie
In-plane-Attribute und Out-of-plane-Attribute
Der Graphit weist eine erhebliche Anisotropie in verschiedenen Richtungen auf. In der Ebene ist die kovalente Bindung stark, mit hoher Härte, Festigkeit und guter elektrischer Leitfähigkeit. So kann man z. B. graphitfaserverstärkte Verbundwerkstoffe als Verstärkungsphase verwenden, um seine Zugfestigkeit in der Ebene zu nutzen. In der vertikalen Richtung der Ebene ist die Van-der-Waals-Kraft zwischen den Schichten schwach, die Festigkeit gering und die Leitfähigkeit schlecht. Diese Eigenschaft macht es zu einem gezielten Vorteil in verschiedenen Anwendungsszenarien spielen.
Vereinbarungen zur Atomenergie
Die Graphitkohlenstoffatome sind nach einem bestimmten Gesetz angeordnet und bilden in der Ebene Sechsecke und im Raum Stapelschichten. Diese Anordnung bestimmt die Kristallstruktur sowie die physikalischen und chemischen Eigenschaften. Mit Hilfe der Röntgenbeugung lassen sich die Kristallinität und die Strukturparameter anhand des spezifischen Musters der geordneten Anordnung bestimmen. Und die Stabilität der atomaren Anordnung sorgt dafür, dass der Graphit in einem bestimmten Temperatur- und Druckbereich eine stabile Leistung erbringt. So kann Graphit als feuerfestes Material bei hohen Temperaturen die Unversehrtheit der Struktur gewährleisten und so die Zuverlässigkeit industrieller Anwendungen schützen.
Gitter- und Kristallstruktur von Graphit
Gitterstruktur von Graphit
Graphit hat eine hexagonale Gitterstruktur, a-Achse und b-Achse sind gleich lang. Der Winkel beträgt 120 Grad, die c-Achse steht senkrecht zur Ebene der Kohlenstoffatome. Seine Länge spiegelt die periodische Anordnung der Schichtstruktur wider und gehört zum hexagonalen Kristallsystem mit spezifischer Symmetrie und kristallographischen Eigenschaften.
Kristallstruktur von Graphit
Der Graphitkristall besteht aus zahlreichen hexagonalen Gittereinheiten, die in geordneter Weise im Raum angeordnet sind. Und die inneren Kohlenstoffatome sind in einer hochgradig geordneten Weise angeordnet. Defekte und Verunreinigungen verändern die Leistung des Kristalls erheblich, indem sie den Elektronen- und Phononentransport, die chemischen Reaktionen und die Gleichmäßigkeit des Materials beeinträchtigen.
Drei häufige Fehler in der Graphitstruktur
Die Defekte in der Graphitstruktur haben einen großen Einfluss auf seine Leistung.
Punktdefekte wie Leerstellen und freie Atome zerstören die atomare Integrität und beeinträchtigen die Elektronenleitung und die mechanischen Eigenschaften.
Lineare Defekte wie Versetzungen beeinflussen die plastische Verformung und die Festigkeit.
Oberflächendefekte, wie z. B. Korngrenzen, behindern die Übertragung von Elektronen und Phononen und verringern die Leitfähigkeit und Wärmeleitfähigkeit. Außerdem führen sie leicht zu chemischen Reaktionen und zur Aggregation von Verunreinigungen.
Graphitstrukturbezogene Konzepte
Graphit-Lewis-Struktur
Die Lewis-Struktur von Graphit zeigt die gemeinsame Nutzung von Elektronen durch die Kohlenstoffatome und erfüllt die stabile Struktur mit acht Elektronen, indem sie kovalente Bindungen mit benachbarten Kohlenstoffatomen bildet. Die unbeteiligten Elektronen bilden delokalisierte π-Elektronenwolken. Dies bildet die Grundlage für das Verständnis chemischer Bindungen und der Elektronenverteilung.
Graphit-Hybridisierung
Die sp2-Hybridisierung der Graphit-Kohlenstoffatome ist die Ursache für seine einzigartige Struktur und seine Eigenschaften. Dies führt zu einer planaren Struktur und einer delokalisierten π-Elektronenwolke, die Graphit eine Vielzahl hervorragender Eigenschaften verleiht.
Graphit-Symbole und -Formeln
Das chemische Symbol von Graphit ist "C". Es ist zwar schwierig, die makromolekulare Struktur mit einer einfachen Molekülformel auszudrücken, aber in der chemischen Berechnung und Reaktionsformel. "C" kann die Reaktion von Graphit darstellen, was die Umwandlung und Erhaltung von Kohlenstoff widerspiegelt.
Graphitstruktur und Bindung
Die Schichtstruktur und die Oberflächeneigenschaften von Graphit sind für seine Bindungseigenschaften von großer Bedeutung. Die Van-der-Waals-Kraft zwischen den Schichten ist schwach, so dass es notwendig ist, die Graphitoberfläche zu modifizieren oder ein geeignetes Bindemittel auszuwählen, um die Wechselwirkung zu verbessern. Bei der Oberflächenmodifizierung können funktionelle Gruppen oder eine Vergröberungsbehandlung eingesetzt werden. Und die polaren Gruppen des Bindemittels können sich stark mit den Kohlenstoffatomen auf der Graphitoberfläche verbinden. Bei Verbundwerkstoffen ist eine gute Bindungsleistung der Schlüssel zur Gewährleistung der gesamten mechanischen und funktionellen Eigenschaften. Eine schlechte Bindung kann leicht zu einer Konzentration von Grenzflächenspannungen führen, was wiederum ein Versagen des Materials zur Folge hat.
Erklären Sie die Struktur von Graphit und anderen Materialien Unterschied
Graphitstruktur vs. Graphenstruktur
Eigentlich, Graphen steht für eine ein Atom dicke Schicht aus Graphit. In jeder 1 mm dicken Graphitplatte befinden sich etwa 3 Millionen übereinander gestapelte Graphenschichten. Graphen kann als eine Schicht von Graphit betrachtet werden, während Graphit aus mehreren übereinander liegenden Schichten von Graphen besteht.
Vergleich der Struktur von Graphit und Diamant
Strukturelle Unterschiede
Die Kohlenstoffatome von Diamant sind sp3-hybridisiert und bilden eine tetraedrische Raumstruktur, und die kovalenten Bindungen zwischen den Atomen sind sehr stark. Graphit ist sp2-Hybrid, planar, hexagonal und geschichtet, mit schwachen Van-der-Waals-Kräften zwischen den Schichten.
Leistungsunterschiede
Strukturelle Unterschiede führen zu deutlichen Leistungsunterschieden. Diamant hat eine sehr hohe Härte und wird für die maschinelle Bearbeitung verwendet; Graphit hat eine weiche Textur, gute Schmierfähigkeit und wird als Schmiermittel und Bleistiftmine verwendet. Graphit leitet Elektrizität, Diamant kaum. Diamant hat einen hohen Brechungsindex und ist transparent, wird in der Schmuckherstellung verwendet; Graphit ist schwarz und undurchsichtig.
Arten der Graphitstruktur
Natürlicher Graphit
Er kommt typischerweise in Graphitschiefer, Graphitgneis, graphithaltigem Schiefer und metamorphem Schiefer vor. Entsprechend der Kristallform, Naturgraphit kann gleichzeitig in zwei Sorten unterteilt werden: kristalliner Graphit, der wiederum in Flockengraphit und kryptokristallinen Graphit, auch als erdiger Graphit bezeichnet, unterteilt wird.
Synthetischer Graphit
Synthetischer Graphit ist eine Art chemisches Produkt. Sein Hauptbestandteil ist Kohlenstoff. Er wird durch Hochtemperaturpyrolyse und Graphitierung von organischen Polymeren gewonnen.
Spezielle Graphitstrukturen wie expandierbarer Graphit und Nanographitstrukturen. Expandierbarer Graphit durch spezielle Behandlung, Zwischenschicht-Einsatzmaterial, Zersetzung und Ausdehnung bei hoher Temperatur, mit guter Flammhemmung, verwendet für feuerfeste Materialien. Nano-Graphit-Strukturen, wie Nano-Graphit-Platten und Nano-Graphit-Fasern, haben eine große spezifische Oberfläche, eine hohe Oberflächenaktivität und ausgezeichnete mechanische Eigenschaften. Es hat ein großes Potenzial in den Bereichen Energiespeicherung, Katalysatorträger und Hochleistungsverbundwerkstoffe.
Korrelation zwischen Graphitstruktur und Verwendung
Die einzigartige Struktur von Graphit bestimmt seine breite Verwendung. Seine gute elektrische Leitfähigkeit macht ihn zu einem Elektrodenmaterial, das in Batterien und elektrolytischen Zellen verwendet wird. Seine hohe Temperaturstabilität und chemische Inertheit machen ihn zu einem feuerfesten Material für die Stahlindustrie. Dank seiner Schmierfähigkeit kann es als Schmiermittel im Maschinenbau eingesetzt werden. In der Luft- und Raumfahrt werden Graphitverbundwerkstoffe aufgrund ihrer geringen Dichte, hohen Festigkeit und thermischen Stabilität für die Herstellung von Flugzeug- und Raketenteilen verwendet. Darüber hinaus spielt Graphit auch eine wichtige Rolle bei der Herstellung von Bleistiften, bei der Graphenherstellung und in anderen Bereichen. Jede Anwendung ist eng mit der Struktur des Graphits verbunden.
Schlussfolgerung
Die Struktur von Graphit ist in vielerlei Hinsicht einzigartig und komplex, was sich erheblich auf seine Leistung und Anwendung auswirkt. Die eingehende Erforschung und das Verständnis der Graphitstruktur eröffnen weitreichende Perspektiven für seine innovative Anwendung in vielen Bereichen wie Materialwissenschaft und Energie. Dies trägt dazu bei, die Material- und Energieprobleme der modernen Gesellschaft zu lösen.