La grafite, come allotropo chiave del carbonio, svolge un ruolo importante in molti campi. L'esplorazione approfondita della sua struttura è la chiave per sbloccare l'ampio potenziale applicativo della grafite e lo sviluppo di nuovi materiali.
Indice dei contenuti
Toggle
Che cos'è la grafite?
La grafite, un minerale composto da atomi di carbonio, è ampiamente diffusa in natura. Ha una lucentezza metallica e una sensazione morbida e levigata al tatto. Questo la rende un materiale ideale per le mina delle matite. Il colore della grafite è per lo più nero o grigio scuro. La sua purezza e il grado di cristallizzazione variano a seconda dell'ambiente di formazione.
Struttura atomica e molecolare della grafite
Struttura atomica della grafite
La composizione principale della grafite è il carbonio. Gli atomi di carbonio della grafite sono collegati da legami covalenti. Ogni atomo di carbonio e i tre atomi di carbonio circostanti formano una struttura ad anello esagonale stabile, che si estende indefinitamente nel piano per formare uno scheletro atomico solido.
Struttura molecolare della grafite
A livello molecolare, la grafite è composta da strati di atomi di carbonio impilati l'uno sull'altro. Gli atomi di carbonio interstrato sono mantenuti da forze di van der Waals relativamente deboli. Questa struttura stratificata spiega perché la grafite ha un'eccellente lubricità e facilità di scorrimento tra gli strati.
Due elementi chiave della struttura della grafite
Struttura cristallina esagonale della grafite
Disposizioni
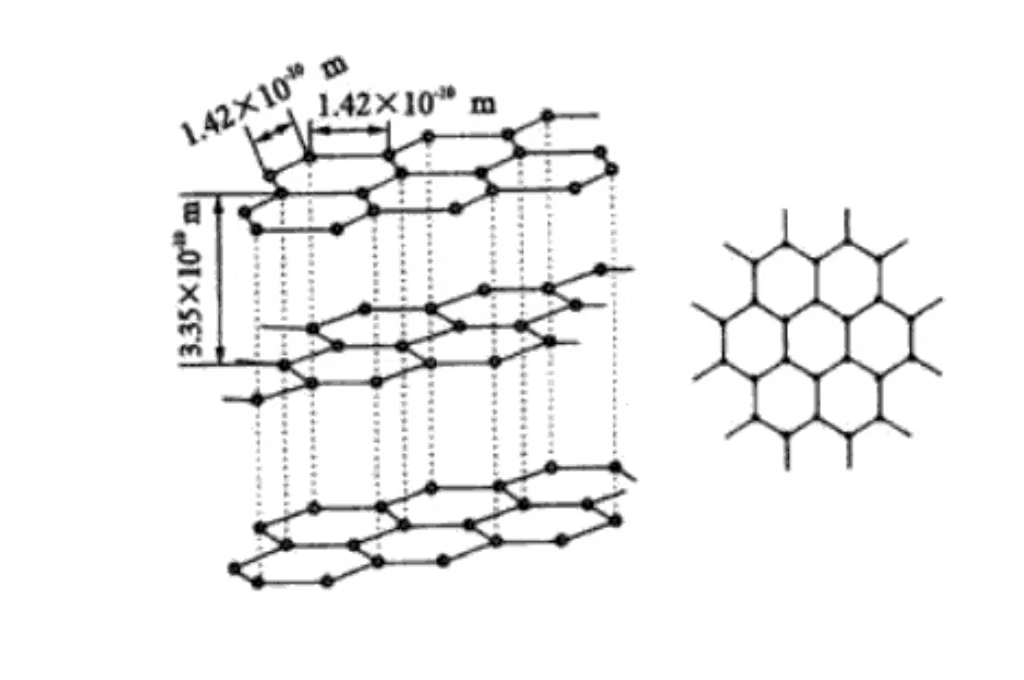
La grafite ha una struttura cristallina esagonale, gli atomi di carbonio sono strettamente disposti in esagoni nel piano, compreso un angolo di 120 gradi. La disposizione è regolare e stabile, favorisce la conduzione degli elettroni ed è alla base della sua buona conducibilità elettrica.
Stratificazione
Gli atomi di carbonio sono impilati in piani paralleli, la distanza tra gli strati è di circa 0,335 nm. La forza di van der Waals tra gli strati è debole, il che rende la grafite facile da far scorrere tra gli strati esterni e ha una certa lubrificazione. È comunemente utilizzata come lubrificante nel campo della produzione meccanica.
Strati della struttura cristallina
Ogni strato di atomi di carbonio forma un piano di rete attraverso legami covalenti. La disposizione ordinata nello spazio conferisce alla grafite le caratteristiche cristalline macroscopiche e l'anisotropia. Il forte legame covalente tra gli strati fa sì che la grafite abbia un'elevata resistenza e durezza sul piano. La direzione verticale del piano ha una bassa resistenza a causa della debole forza interstrato.
Legami all'interno degli atomi di carbonio
Forze di Van der Waal
Gli atomi di carbonio interstrato si affidano alla forza di van der Waals, che è debole e determina una facile separazione di scorrimento tra gli strati di grafite e la lubrificazione. Tuttavia, in determinate condizioni (come l'alta temperatura e la pressione), la struttura interstrato della grafite è variabile. Ad esempio, può trasformarsi in una struttura a diamante.
Separazione degli strati
Grazie alla debole forza di van der Waals, lo strato di grafite può essere separato applicando una piccola forza di taglio. Questo non solo riflette la lubricità, ma crea anche la possibilità di reazioni di intercalazione, attraverso le quali le proprietà fisiche e chimiche della grafite possono essere modificate per preparare speciali materiali compositi. Come ad esempio i materiali per elettrodi negativi delle batterie agli ioni di litio.
Legami covalenti
Gli atomi di carbonio nello strato sono strettamente connessi da legami covalenti per formare una struttura esagonale stabile. Ciò determina l'elevata durezza e resistenza della grafite nel piano, garantendo la sua stabilità strutturale nell'applicazione dei materiali per elettrodi. Inoltre, limita il movimento degli elettroni, influenzando l'anisotropia nel piano.
Ibridazione Sp2
Angolo di legame
Gli atomi di carbonio adottano l'ibridazione sp2, un orbitale 2s e due 2p si ibridano per formare tre orbitali equivalenti di ibridazione sp2. Questi sono distribuiti in un triangolo piano con un angolo di circa 120 gradi. Gli atomi di carbonio formano quindi legami covalenti stabili con tre atomi di carbonio adiacenti per costruire una struttura esagonale, che favorisce la delocalizzazione degli elettroni e una buona conducibilità elettrica.
Atomi di carbonio
L'atomo di carbonio costruisce uno scheletro planare con tre atomi di carbonio circostanti attraverso orbitali ibridi sp2. I piani verticali degli orbitali 2p non ibridi si sovrappongono per formare nuvole di elettroni π delocalizzate. Le nuvole di elettroni π conferiscono alla grafite una buona conducibilità elettrica, in cui gli elettroni possono muoversi liberamente in risposta ai cambiamenti dei campi elettrici. Inoltre, rendono la grafite attiva nelle reazioni chimiche e partecipano ai processi elettrochimici. Ad esempio, come mezzo di trasferimento degli elettroni nelle batterie agli ioni di litio.
Anisotropia
Attributi in piano e attributi fuori piano
La grafite mostra una significativa anisotropia in diverse direzioni. Nel piano, il legame covalente è forte, con elevata durezza, resistenza e buona conducibilità elettrica. Ad esempio, è possibile utilizzare materiali compositi rinforzati con fibre di grafite come fase di rinforzo per sfruttare la sua resistenza alla trazione in piano. Nella direzione del piano verticale, a causa della debole forza di van der Waals inter-strato, la resistenza è bassa e la conducibilità scarsa. Questa caratteristica lo rende un vantaggio mirato in diversi scenari applicativi.
Accordi sull'energia atomica
Gli atomi di carbonio della grafite si dispongono secondo una legge specifica, formando esagoni nel piano e strati sovrapposti nello spazio. Questa disposizione determina la struttura cristallina e le proprietà fisiche e chimiche. La diffrazione dei raggi X può determinare la cristallinità e i parametri strutturali in base al modello specifico presentato dalla sua disposizione ordinata. La stabilità della disposizione atomica fa sì che la grafite mantenga prestazioni stabili in un determinato intervallo di temperatura e pressione. Ad esempio, la grafite come materiale refrattario ad alta temperatura può garantire l'integrità della struttura, fornendo protezione per l'affidabilità delle applicazioni industriali.
Lattice e struttura cristallina della grafite
Struttura reticolare della grafite
La grafite ha una struttura reticolare esagonale, l'asse a e l'asse b sono di uguale lunghezza. L'angolo è di 120 gradi e l'asse c è perpendicolare al piano dell'atomo di carbonio. La sua lunghezza riflette la disposizione periodica della struttura a strati, appartiene al sistema cristallino esagonale, con specifiche caratteristiche di simmetria e cristallografia.
Struttura cristallina della grafite
Il cristallo di grafite è costituito da numerose unità reticolari esagonali disposte in modo ordinato nello spazio. Gli atomi di carbonio interni sono disposti in modo altamente ordinato. I difetti e le impurità ne modificano significativamente le prestazioni, influenzando il trasporto di elettroni e foni, le reazioni chimiche e l'uniformità del materiale.
Tre difetti comuni nella struttura della grafite
I difetti nella struttura della grafite hanno una grande influenza sulle sue prestazioni.
I difetti puntiformi, come gli atomi vacanti e gli atomi liberi, distruggono l'integrità atomica e influenzano la conduzione degli elettroni e le proprietà meccaniche.
I difetti lineari come le dislocazioni influenzano la deformazione plastica e la resistenza.
I difetti superficiali, come i confini dei grani, ostacolano la trasmissione di elettroni e fononi, riducono la conduttività e la conducibilità termica. Inoltre, portano facilmente a reazioni chimiche e all'aggregazione di impurità.
Concetti relativi alla struttura della grafite
Struttura di Lewis della grafite
La struttura di Lewis della grafite mostra la condivisione degli elettroni tra gli atomi di carbonio e soddisfa la struttura stabile a otto elettroni formando legami covalenti con gli atomi di carbonio vicini. Gli elettroni non coinvolti formano nuvole di elettroni π delocalizzati. Questo fornisce le basi per la comprensione del legame chimico e della distribuzione degli elettroni.
Ibridazione della grafite
L'ibridazione sp2 degli atomi di carbonio della grafite è alla base della sua struttura e delle sue proprietà uniche. Il risultato è una struttura planare, una nuvola di elettroni π delocalizzati, che conferisce alla grafite una serie di eccellenti proprietà.
Simboli e formule della grafite
Il simbolo chimico della grafite è "C". Anche se è difficile esprimere la struttura macromolecolare con una semplice formula molecolare, ma nel calcolo chimico e nella formula di reazione. "C" può rappresentare la reazione della grafite, riflettendo la trasformazione e la conservazione del carbonio.
Struttura e legame della grafite
La struttura a strati e le proprietà superficiali della grafite sono di grande importanza per le sue proprietà di legame. La forza di van der Waals tra gli strati è debole, quindi è necessario modificare la superficie della grafite o selezionare un legante adatto per migliorare l'interazione. La modifica della superficie può introdurre gruppi funzionali o un trattamento di coartazione. I gruppi polari del legante possono legarsi fortemente con gli atomi di carbonio sulla superficie della grafite. Nei materiali compositi, una buona prestazione di legame è la chiave per garantire le proprietà meccaniche e funzionali complessive. Un legame insufficiente può causare una concentrazione di tensioni interfacciali, con conseguente rottura del materiale.
Spiegare la struttura della grafite e la differenza tra altri materiali
Struttura della grafite e struttura del grafene
In realtà, grafene rappresenta uno strato di grafite dello spessore di un atomo. In ogni foglio di grafite dello spessore di 1 mm ci sono circa 3 milioni di strati di grafene impilati l'uno sull'altro. Il grafene può essere considerato come uno strato di grafite, mentre la grafite è costituita da diversi strati di grafene sovrapposti.
Confronto tra la struttura della grafite e del diamante
Differenze strutturali
Gli atomi di carbonio del diamante adottano l'ibridazione sp3 per formare una struttura spaziale tetraedrica e i legami covalenti tra gli atomi sono molto forti. La grafite è esagonale planare ibrida sp2 e stratificata, con deboli forze di van der Waals tra gli strati.
Differenze di prestazioni
Le differenze strutturali si traducono in differenze di prestazioni. La durezza del diamante è molto elevata e viene utilizzata per le lavorazioni meccaniche; la grafite ha una consistenza morbida e una buona lubricità, viene utilizzata come lubrificante e come mina per matite. La grafite conduce l'elettricità, il diamante difficilmente. Il diamante ha un elevato indice di rifrazione e trasparenza, utilizzato in gioielleria; la grafite è nera e opaca.
Tipi di struttura della grafite
Grafite naturale
Si presenta tipicamente in scisti grafitici, gneiss grafitici, scisti grafitici e scisti metamorfici. Secondo la forma cristallina, grafite naturale può essere suddivisa contemporaneamente in due varietà: la grafite cristallina, che si divide ulteriormente in grafite a scaglie e grafite criptocristallina, nota anche come grafite terrosa.
Grafite sintetica
Grafite sintetica è un tipo di prodotto chimico. Il suo ingrediente principale è il carbonio. Si ottiene attraverso la pirolisi ad alta temperatura e la grafitizzazione di polimeri organici.
Strutture speciali di grafite, come la grafite espandibile e le strutture di nanografite. La grafite espandibile è sottoposta a un trattamento speciale, materiale di inserzione intercalare, decomposizione ed espansione ad alta temperatura, con un buon ritardante di fiamma, utilizzato per materiali ignifughi. Le strutture di nano-grafite, come i fogli di nano-grafite e le fibre di nano-grafite, hanno un'ampia superficie specifica, un'elevata attività superficiale ed eccellenti proprietà meccaniche. Ha un grande potenziale nei settori dell'accumulo di energia, dei vettori di catalizzatori e dei materiali compositi ad alte prestazioni.
Correlazione tra struttura e uso della grafite
La struttura unica della grafite ne determina l'ampio utilizzo. La buona conducibilità elettrica la rende un materiale per elettrodi, utilizzato nelle batterie e nelle celle elettrolitiche. La stabilità alle alte temperature e l'inerzia chimica ne fanno un refrattario per l'industria siderurgica. La lubrificazione gli consente di agire come lubrificante nella produzione di macchinari. Nel settore aerospaziale, i compositi di grafite sono utilizzati nella produzione di componenti per aerei e razzi grazie alla loro bassa densità, all'elevata resistenza e alla stabilità termica. Inoltre, la grafite svolge un ruolo importante anche nella produzione di matite, nella preparazione del grafene e in altri campi. Ogni applicazione è strettamente legata alla struttura della grafite.
Conclusione
La struttura della grafite mostra la sua unicità e complessità da molteplici dimensioni, che influenzano profondamente le prestazioni e le applicazioni. La ricerca approfondita e la comprensione della struttura della grafite aprono ampie prospettive per la sua applicazione innovativa in molti campi come la scienza dei materiali e l'energia. E questo aiuta a superare i problemi materiali ed energetici della società moderna.