Grafiet, een allotroop van koolstof, komt vaak voor in het dagelijks leven en in industriële productie. Wat is het eigenlijk? Is het een metaal, mineraal of element? Waar is het van gemaakt? Dit artikel gaat dieper in op de aard van grafiet en onthult zijn vele geheimen. En laat de unieke charme en belangrijke waarde van grafiet zien op het gebied van wetenschap en toepassing.
Inhoudsopgave
SchakelDefinitie van grafiet
Grafiet is een kristallijne vorm van koolstof, die meestal een grijszwarte en ondoorzichtige vaste toestand vertoont, met een unieke metaalglans. Maar soms heeft het een andere vorm, de amorfe vorm, die bestaat uitirreeulaire ordeningen van grafietatomen. Het heeft een relatief zachte textuur, waardoor het duidelijke sporen op het papier achterlaat. Deze eigenschap maakt grafiet ook het hoofdbestanddeel van potloodstiften. In chemische zin behoort grafiet tot de allotrope koolstof, die bestaat uit koolstofatomen zoals diamant, fullereen en andere stoffen. De manier waarop koolstofatomen in deze stoffen zijn gerangschikt is echter heel verschillend, wat resulteert in enorme verschillen in hun fysische en chemische eigenschappen.
Is grafiet een metaal of een mineraal?
Grafiet is geen metaal, maar een mineraal. Metaal heeft meestal een goede elektrische geleidbaarheid, thermische geleidbaarheid en taaiheid en andere typische kenmerken. Hoewel grafiet een zekere mate van elektrische en thermische geleidbaarheid heeft, heeft het niet de taaiheid die kenmerkend is voor metalen. Grafiet is een natuurlijk product van complexe geologische processen en voldoet aan de definitie van een mineraal. Het komt voor in specifieke gesteenten en afzettingen in de natuur. En het is een belangrijke vorm van koolstof in de lange cyclus en het evolutieproces van de aardcirkel, getuige van de beweging en verandering van materialen in het binnenste van de aarde.
Is grafiet een element?
Grafiet is geen element, maar een stof die bestaat uit koolstof. Een element is een groep atomen met hetzelfde aantal kernladingen (protonen). Grafiet is een materiële entiteit gevormd door een groot aantal koolstofatomen die met elkaar verbonden zijn door specifieke chemische bindingen. Deze zuivere stof die uit dezelfde elementen bestaat, wordt elementair genoemd. Grafiet is een speciale vorm van elementair koolstof. Het heeft een unieke kristalstructuur en fysische en chemische eigenschappen die de rijke en diverse eigenschappen van koolstof laten zien.
Is grafiet koolstof?
Grafiet is een allotroop van koolstof en bestaat volledig uit het element koolstof. Binnenin het grafiet zijn de koolstofatomen op een heel speciale manier gerangschikt en gecombineerd om een unieke kristalstructuur te vormen. Deze structuur geeft grafiet veel speciale eigenschappen. Zo verschillen grafiet en andere koolstofallotropen zoals diamant (bekend om zijn harde en transparante eigenschappen) en fullereen (met een unieke bol- of buisstructuur) qua uiterlijk en fysische en chemische eigenschappen aanzienlijk van elkaar. Op veel gebieden spelen ze verschillende rollen.
Waar komt grafiet vandaan?
Natuurlijke bronnen
De natuurlijke bronnen van grafiet in de natuur zijn uitgebreider. Een deel van het grafiet vinden we in metamorfe gesteenten. In het proces van regionaal metamorfisme bijvoorbeeld, worden de oorspronkelijke koolstofhoudende sedimenten (zoals steenkoollagen) geleidelijk omgezet in grafiet door complexe metamorfe kristallisatie onder extreme omstandigheden van hoge temperatuur en druk. Daarnaast is sommige grafiet afkomstig van magmatische gesteenten. En wanneer het magma de korst binnendringt, kristalliseert de koolstof in het magma onder specifieke geologische omgeving en fysische en chemische omstandigheden. Zo ontstaat grafiet. Natuurlijke grafietafzettingen zijn te vinden in veel landen en regio's over de hele wereld, waaronder China, Brazilië, India en andere landen met relatief rijke natuurlijke grafietvoorraden. Deze vormen een belangrijke materiële basis voor de ontwikkeling van grafietgerelateerde industrieën wereldwijd.
Kunstmatig grafiet
Met de snelle ontwikkeling van de moderne industriële technologie is de productie van kunstmatig grafiet geleidelijk een belangrijk onderdeel geworden van de grafietvoorziening. Kunstmatig grafiet wordt meestal geproduceerd door hittebehandeling bij hoge temperatuur van specifieke koolstofhoudende grondstoffen (zoals petroleumcoke, asfaltcoke, enz.). Het zet amorf koolstof in grafiet. Bij hoge temperaturen zullen de niet-koolstofelementen in deze koolstofhoudende grondstoffen geleidelijk vervliegen. De koolstofatomen herschikken en kristalliseren en vormen uiteindelijk kunstmatig grafiet met een structuur die lijkt op die van natuurlijk grafiet. De productie van kunstmatig grafiet is in hoge mate beheersbaar. En het kan de zuiverheid, kristalstructuur en fysische en chemische eigenschappen nauwkeurig regelen volgens de verschillende industriële toepassingsbehoeften. Daarom wordt het op grote schaal gebruikt op vele gebieden, zoals staal, batterijen, vuurvaste materialen, enzovoort. Dit biedt een sterke ondersteuning voor de ontwikkeling van de moderne industrie.
Soorten grafiet
Samengevat kan grafiet voornamelijk worden onderverdeeld in natuurlijk grafiet en synthetisch grafiet twee soorten.
Natuurlijk grafiet
Natuurlijk grafiet omvat ook vlokgrafiet, kristallijn grafiet en cryptokristallijn grafiet.
Vlokgrafiet wordt gekenmerkt door een grote en dunne vlokvorm met een breed diameterbereik, variërend van enkele tienden van een millimeter tot enkele millimeters. Deze schubben hebben een goed elektrisch en thermisch geleidingsvermogen in de vlakke richting, terwijl hun gelaagde structuur het uitstekende smeereigenschappen geeft.
Kristallijne grafietkristallen zijn goed ontwikkeld en vertonen een duidelijke hexagonale lamellaire kristalvorm. De schubben zijn relatief groot en de diameter van de plakjes is vaak meer dan 0,1-0,2 mm. Dit type grafiet komt niet veel voor in de natuur. Maar vanwege de uitstekende kristalstructuur en unieke eigenschappen speelt het een rol in veel hoogwaardige industriële gebieden.
Het kristal van weesgrafiet is erg klein en bestaat in de vorm van microkristallijne aggregaten. En de specifieke vorm van het kristal kan nauwelijks met het blote oog worden onderscheiden. Het vaste koolstofgehalte is hoog, ruwweg 60%-80%. In industriële toepassingen kunnen we kristallijn grafiet gebruiken als giet- en vuurvaste materialen.
Synthetisch grafiet
Synthetisch grafiet bestaat uit drie soorten, elk met unieke eigenschappen en toepassingen.
De zuiverheid van grafiet is extreem hoog, het gehalte aan onzuiverheden is zeer laag, meestal meer dan 99,9%. Door de uitstekende chemische stabiliteit en het hoge elektrische geleidingsvermogen speelt het een belangrijke rol in de halfgeleiderproductie, de high-end chemische industrie en andere industrieën met strenge zuiverheidseisen.
Isostatisch geperst grafiet wordt gevormd door isostatisch persen en heeft de kenmerken van uniforme structuur en isotropie. Het heeft uitstekende mechanische sterkte, weerstand tegen hoge temperaturen en thermische schokbestendigheid, uitstekende prestaties op het gebied van metallurgie, EDM en andere gebieden.
Geëxpandeerd grafiet wordt gemaakt van natuurlijk grafiet door een speciale behandeling, met een unieke wormachtige structuur. Dit kan snel uitzetten bij hoge temperaturen en vormt zo een materiaal met uitstekende thermische isolatie en afdichtingseigenschappen. Op het gebied van brandwerende materialen kan geëxpandeerd grafiet worden gebruikt voor de vervaardiging van brandwerende afdichtingen, brandwerende coatings, enz. Het kan de verspreiding van vuur effectief voorkomen.
Waar is grafiet van gemaakt?
Grafiet Element
Het belangrijkste bestanddeel van grafiet is koolstof. In grafiet zijn koolstofatomen met elkaar verbonden door covalente bindingen, waardoor een vlak netwerk van zeshoeken ontstaat. Deze vlakke netwerkstructuren worden laag op laag in de ruimte gestapeld en vormen zo de unieke kristalstructuur van grafiet. Elk koolstofatoom vormt een covalente binding met drie omliggende koolstofatomen. En de aanwezigheid van deze covalente binding geeft grafiet een hoge stabiliteit en sterkte binnen de laag. Het legt ook de basis voor enkele van zijn speciale eigenschappen, zoals elektrische en thermische geleidbaarheid.
De chemische formule van grafiet
De chemische formule van grafiet wordt meestal aangeduid met C, wat duidelijk aangeeft dat het volledig uit koolstof bestaat. Ondanks de eenvoudige chemische formule vertoont grafiet complexe en uiteenlopende fysische en chemische eigenschappen. Dit komt door de unieke rangschikking van koolstofatomen en het bestaan van vele vormen van chemische binding. Dit kenmerk, dat bestaat uit een enkel element maar rijke eigenschappen heeft, zorgt ervoor dat grafiet een unieke positie inneemt op het gebied van materiaalkunde. En het wordt ook de focus van tal van onderzoeken en toepassingen.
Grafiet Structuur
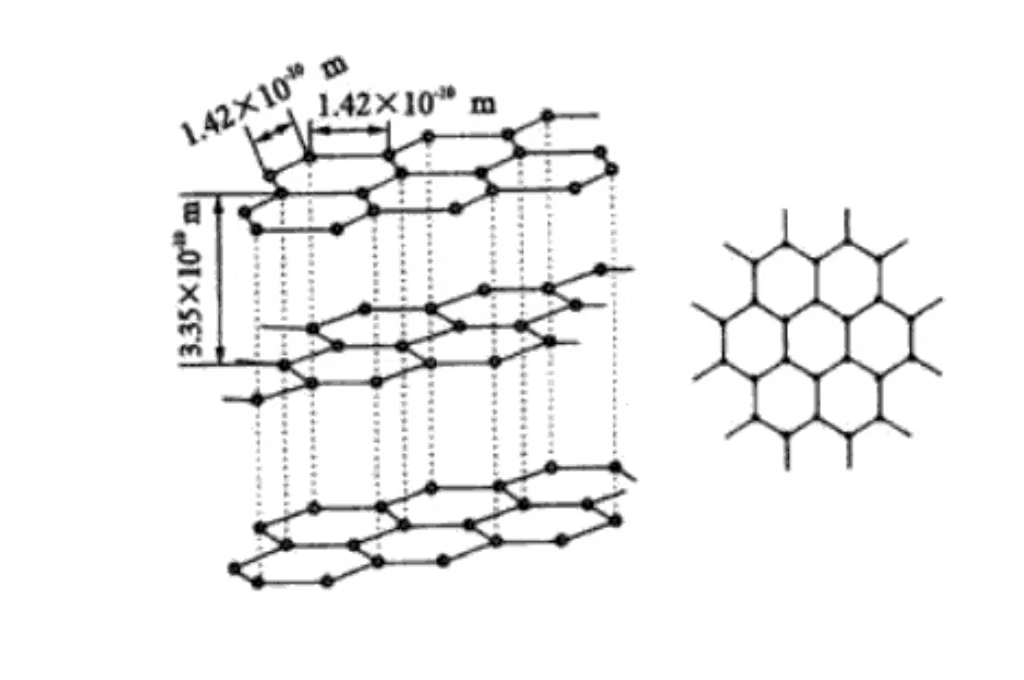
Koolstof Rangschikking van koolstofatomen in grafiet
Koolstof is gerangschikt in de microstructuur van grafiet. En de koolstofatomen vertonen een opmerkelijke gelaagde ordening. Elke laag koolstofatomen is nauw gerangschikt om een enorme hexagonale vlakke netwerkstructuur te vormen. En de koolstofatomen zijn nauw met elkaar verbonden door middel van covalente bindingen. Hierdoor hebben deze vlakke lagen een hoge stabiliteit en sterkte, en kunnen ze een bepaalde mate van externe kracht weerstaan zonder schade. De laag tussen de laag wordt gevormd door de zwakke van der Waals-krachtinteractie. Deze relatief zwakke kracht tussen de lagen zorgt ervoor dat het grafiet tussen de laag en de laag bij een kleine externe kracht gemakkelijk kan glijden, waardoor het grafiet goed smeert en flexibel is. Zodat het wrijving moet verminderen en een zekere vervormbaarheid moet hebben in het toepassingsscenario.
Verbinding
De covalente binding tussen koolstofatomen in de grafietlaag is een sterke chemische binding. Deze zorgt niet alleen voor de stabiliteit en integriteit van de grafietlaag, maar heeft ook een grote invloed op de fysieke eigenschappen van grafiet. Door het bestaan van covalente bindingen kunnen elektronen relatief vrij bewegen tussen de koolstofatomen in de laag. Hierdoor heeft het grafiet een goed geleidend en thermisch geleidingsvermogen binnen de laag en kan het efficiënt stroom en warmte overdragen.
De van der Waals kracht tussen de lagen is relatief zwak. En de bijdrage aan de fysische eigenschappen van grafiet zoals hardheid en dichtheid is kleiner dan die van covalente bindingen. Dit synergetische effect van covalente bindingen binnen de lagen en van der Waals krachten tussen de lagen creëert de unieke anisotrope eigenschappen van grafiet. Dat wil zeggen dat de fysische en chemische eigenschappen van grafiet in de richting van de laag en de verticale laag aanzienlijk verschillen. Deze eigenschap moet volledig in aanmerking worden genomen bij materiaaltoepassingen om optimaal gebruik te kunnen maken van de eigenschappen van grafiet.
Eigenschappen van grafiet
Fysische eigenschappen
Kleur
Grafiet heeft meestal een grijszwarte verschijningskleur. De vorming van deze kleur is nauw verbonden met de interne elektronische structuur van grafiet en de absorptie- en reflectiekarakteristieken van licht. De koolstofatomen in grafiet absorberen en verstrooien zichtbaar licht door specifieke chemische bindingen en elektronenwolkverdeling. Zo wordt het meeste zichtbare licht geabsorbeerd en wordt slechts een kleine hoeveelheid licht gereflecteerd of verstrooid. Dit geeft een grijs-zwart visueel effect op macroniveau. Bovendien geeft de ondoorzichtige aard van grafiet het uiterlijk ook een unieke textuur, in scherp contrast met andere transparante of doorschijnende materialen.
Dichtheid
De dichtheid van grafiet is relatief klein, tussen ongeveer 2,09-2,23 g/cm3. Ook het soortelijk gewicht is laag. Deze eigenschap maakt grafiet tot een duidelijk voordeel in sommige toepassingsscenario's met strenge gewichtseisen. Bijvoorbeeld bij het ontwerp van bepaalde onderdelen in de lucht- en ruimtevaart, als je materialen moet gebruiken die een bepaalde mate van geleidende eigenschappen en smeerbaarheid hebben, maar ook het totale gewicht kunnen verminderen. Dan is grafiet een zeer geschikt kandidaat-materiaal.
Smeltpunt
Grafiet heeft een zeer hoog smeltpunt, ongeveer 3652 °C -3697 °C. Door deze uitstekende stabiliteit bij hoge temperaturen kan grafiet zijn structuur en eigenschappen relatief stabiel houden in omgevingen met extreem hoge temperaturen. Bij het smelten van ijzer en staal, vuurvaste materialen en andere industriële processen bij hoge temperaturen speelt grafiet een essentiële rol.
Elektrische geleidbaarheid
Grafiet heeft een uitstekend elektrisch geleidingsvermogen in de laag, wat te danken is aan de vorming van een stabiele elektronenwolkstructuur tussen de koolstofatomen in de laag door middel van covalente bindingen. En elektronen kunnen relatief vrij bewegen in deze structuur, om zo een efficiënte geleiding van stroom te bereiken. Tegelijkertijd is de thermische geleidbaarheid van grafiet ook erg goed en kan het snel warmte overdragen.
Smering
De smeereigenschappen van smeergrafiet zijn te danken aan de unieke gelaagde structuur. De van der Waals kracht tussen de lagen is zwak. Wanneer er een externe kracht op het grafiet wordt uitgeoefend, zal het relatieve glijden tussen de lagen gemakkelijk plaatsvinden. En dit glijdende proces kan de wrijvingscoëfficiënt effectief verminderen, zodat het een goede smerende rol kan spelen. Of het nu gaat om het dagelijkse smeringsonderhoud van diverse mechanische apparatuur in de machine-industrie, of om de smeringsbehoeften in sommige speciale omgevingen (zoals een omgeving met hoge temperatuur, hoge druk of chemische corrosie), grafiet kan uitstekende smeringseffecten laten zien.
Chemische eigenschappen
Weerstand tegen grafietcorrosie
Grafiet is goed bestand tegen zuren en alkaliën. Het kan een relatief stabiele structuur en prestaties behouden in zure en alkalische oplossingen binnen een bepaald concentratiebereik. Dit komt doordat de koolstofatomen in grafiet een stabiele chemische bindingsenergiestructuur vormen door middel van covalente bindingen. Hierdoor kan grafiet moeilijk worden vernietigd door ionen in zure en basische oplossingen. Door deze zuur- en alkalibestendigheid heeft grafiet een belangrijke toepassingswaarde in sommige corrosieve omgevingen in de chemische industrie.
Reactiviteit met andere materialen
Onder normale temperatuuromstandigheden zijn de chemische eigenschappen van grafiet relatief stabiel. En het reageert niet gemakkelijk chemisch met de meest voorkomende stoffen. Wanneer grafiet echter wordt blootgesteld aan hoge temperatuur, hoge druk of een specifieke chemische omgeving, kan het reageren met sommige oxidanten (zoals zuurstof, geconcentreerd zwavelzuur, enz.).
Wanneer er bijvoorbeeld voldoende zuurstof is en de temperatuur in zekere mate stijgt, zal het grafiet een oxidatiereactie ondergaan en geleidelijk overgaan in producten zoals koolstofdioxide. Deze reactiviteit beperkt de toepassing van grafiet in sommige extreme oxidatieomgevingen tot op zekere hoogte. Maar het biedt ook de mogelijkheid voor speciale behandeling en modificatie van grafiet.
Thermische uitzettingscoëfficiënt
Grafiet heeft een lage thermische uitzettingscoëfficiënt, waardoor het goed dimensionaal stabiel is wanneer de temperatuur verandert. Vergeleken met veel andere materialen verandert het volume van grafiet heel weinig tijdens het proces van een grotere temperatuurstijging en -daling.
In sommige toepassingen die een hoge maatnauwkeurigheid van materialen vereisen, is deze lage thermische uitzettingscoëfficiënt van grafiet bijzonder belangrijk. Het kan problemen zoals vervorming van onderdelen en vermindering van de assemblagenauwkeurigheid als gevolg van temperatuurschommelingen effectief voorkomen. Om de normale werking en stabiele prestaties van apparatuur of instrumenten in verschillende temperatuuromgevingen te garanderen.
Oxidatie
Hoewel grafiet een sterke oxidatie- en corrosiebestendigheid vertoont bij kamertemperatuur, zal grafiet onder extreme omstandigheden zoals hoge temperatuur, hoge vochtigheid of sterke oxidatieomgeving geleidelijk oxideren en corrosie veroorzaken. Bij langdurige blootstelling aan hoge temperaturen in de lucht zullen de koolstofatomen op het oppervlak van grafiet bijvoorbeeld reageren met zuurstof en een oxidelaag vormen.
En na verloop van tijd zal de voortdurende verdikking van de oxidelaag leiden tot veranderingen in de structuur en prestaties van grafiet. Zoals verminderde geleidbaarheid en sterkte. Daarom is het in sommige toepassingsgebieden met hoge eisen aan de oxidatiebestendigheid van grafiet vaak nodig om grafiet een speciale oppervlaktebehandeling te geven. Of antioxidanten en andere maatregelen toe te voegen. Om de antioxidantcapaciteit te verbeteren en de prestatiestabiliteit en betrouwbaarheid van grafietmaterialen tijdens het gebruik te garanderen.
Mechanische eigenschappen
Hardheid en sterkte
De sterkte en hardheid van grafiet zijn relatief laag en de Mohs-hardheid is ongeveer 1-2. Door deze eigenschap is grafiet relatief gemakkelijk te vormen en tijdens de verwerking in verschillende vormen te verwerken. Door grafiet en andere materialen zoals klei in verschillende verhoudingen te mengen en te persen, kunnen bijvoorbeeld bij de productie van potloodstiften stiften met verschillende hardheden worden gemaakt om aan verschillende schrijfbehoeften te voldoen. Hoewel de totale sterkte van grafiet laag is, heeft het in sommige specifieke richtingen toch een bepaalde gebruikswaarde voor de sterkte. Bijvoorbeeld in de richting van de grafietlaag.
Elasticiteit
Door de unieke gelaagde structuur van grafiet vertoont het tot op zekere hoogte flexibiliteit en elasticiteit. Wanneer we een kleine externe kracht uitoefenen, kunnen we de gelaagde structuur van grafiet tot op zekere hoogte buigen en vervormen. En wanneer de externe kracht wordt verwijderd, kunnen we het grafiet weer in de oorspronkelijke vorm of bijna in de oorspronkelijke vorm terugbrengen. Deze flexibiliteit en elasticiteit maken grafiet tot een potentiële toepassing in sommige flexibele elektronische apparaten, afdichtingsmaterialen en andere opkomende gebieden.
Anisotropie
Anisotroop grafiet heeft zeer duidelijke anisotrope eigenschappen. Dat wil zeggen dat de fysische en chemische eigenschappen aanzienlijk verschillen in verschillende richtingen. In termen van geleidende eigenschappen is het geleidingsvermogen langs de grafietlaag veel hoger dan het geleidingsvermogen in de verticale laag. Dit wordt veroorzaakt door de bevordering van covalente bindingen op elektronengeleiding en de belemmering van de van der Waals kracht tussen de lagen op elektronengeleiding.
De hardheid en sterkte van de verticale laag zijn relatief hoog. Omdat de van der Waals kracht tussen de lagen het relatieve glijden tussen de lagen tot op zekere hoogte beperkt. Terwijl glijden en vervorming eerder optreden door de zwakke kracht tussen de lagen. Deze anisotrope eigenschap vereist speciale aandacht en overweging in het toepassingsproces van grafiet. Afhankelijk van de specifieke toepassingseisen is het redelijk om de eigenschappen van grafiet in verschillende richtingen te selecteren en te gebruiken. Zo kunnen de prestaties van grafietmaterialen maximaal worden benut en kan het toepassingseffect worden geoptimaliseerd.
Thermische en elektrische eigenschappen
Er is een nauwe interne relatie tussen thermische en elektrische eigenschappen van grafiet en thermische eigenschappen en uitstekende prestaties. Zijn hoge thermische geleidbaarheid is voldoende om snel warmte af te geven, wat van grote toepassingswaarde is op het gebied van warmteafvoer van elektronische apparatuur. Tegelijkertijd zorgt het goede geleidingsvermogen van grafiet ervoor dat het efficiënt stroom kan overbrengen als een uitstekende geleider in het circuit.
Andere eigenschappen
Naast de vele eigenschappen die hierboven zijn genoemd, heeft grafiet nog een aantal andere speciale eigenschappen. Grafiet heeft bijvoorbeeld bepaalde adsorberende eigenschappen. De rijke poriënstructuur en het grote specifieke oppervlak kunnen bepaalde gassen en kleine moleculen absorberen. Deze eigenschap heeft potentiële toepassingswaarde in gaszuivering en rioolwaterzuivering op het gebied van milieubescherming. Door grafiet op de juiste manier te modificeren en te behandelen, kunnen de adsorptieprestaties nog verder worden verbeterd. Het kan worden gebruikt om schadelijke gassen in de lucht (zoals formaldehyde, zwaveldioxide, enz.) of zware metaalionen in water, organische verontreinigende stoffen, enz. te verwijderen.
6 Toepassingen van grafiet
In potloden
Grafiet is een belangrijk bestanddeel van potloodstift. Door zijn zachte textuur en unieke gelaagde structuur kan het duidelijke sporen achterlaten op papier na vermenging en aanpassing van de hardheid met klei om te voldoen aan de behoeften van schrijven en schilderen. Van het leren van studenten tot artistieke creatie, het wordt veel gebruikt in allerlei schrijfgereedschappen. Hierdoor kunnen mensen hun ideeën en creativiteit vrijelijk uiten.
Als smeermiddel
Grafiet als smeermiddel heeft een goede smering door de zwakke van der Waals-kracht in de middelste laag en de tussenlaag van de gelaagde structuur. Het wordt veel gebruikt op mechanisch gebied. Of het nu gaat om de interne bewegende delen van automotoren of industriële mechanische transmissiedelen. Of zelfs de lucht- en ruimtevaartonderdelen op hoge temperatuur en onder hoge druk, grafietpoeder kan de wrijving en slijtage effectief verminderen. Het zorgt ook voor een soepele en efficiënte werking van de apparatuur en verlengt de levensduur.
Staal maken
Grafiet speelt een belangrijke rol bij de productie van staal. Als elektrodeHet kan stroom introduceren om Joule-warmtesmelting van schrootstaalgrondstoffen te produceren. Als carburateur kan het koolstofgehalte van gesmolten staal nauwkeurig worden aangepast. Gemaakt van het materiaal van de ovenvoering, krachtens weerstand op hoge temperatuur en corrosieweerstand, bescherm het ovenlichaam van de staalfabricage tegen op hoge temperatuur gesmolten staal en slakkenschade. Bovendien heeft grafiet een bepaalde specifieke warmtecapaciteit. Het kan warmte absorberen en afgeven tijdens het staalproductieproces en helpt temperatuurschommelingen in de oven te reguleren. Ondersteun effectief de efficiënte, veilige en stabiele ontwikkeling van het staalproductieproces.
Batterij
Grafiet is van groot belang in batterijen en wordt vaak gebruikt als negatief elektrodemateriaal in lithium-ionbatterijen. batterijen. De gelaagde structuur biedt ruimte voor lithium-ion embedment en deembedment, opladen embedment, ontlading ontlading, met een goede geleidende eigenschap. Dit zorgt voor de laad- en ontlaadcyclus van de batterij. In het onderzoek naar opkomende batterijtechnologie wordt het ook beschouwd als het basismateriaal. Dit speelt een rol bij het bevorderen van de ontwikkeling van nieuwe energieopslag.
Vuurvaste materialen
Grafiet heeft een hoog smeltpunt en een hoge temperatuurstabiliteit en is een vuurvast materiaal van hoge kwaliteit. In de metallurgie, keramiek, glas en andere industriële hoge temperatuur processen, gebruikt bij de vervaardiging van vuurvaste stenen, voeringen kroezen enzovoort. Het kan de erosie van metaalsmelting en slakken in een omgeving op hoge temperatuur weerstaan en de structurele stabiliteit handhaven. Verminder warmteverlies, verminder het risico op ongelukken en bouw een sterke veiligheidslijn voor industriële productie op hoge temperatuur.
Kernreactoren
Grafiet dient als neutronenmoderator in kernreactoren. Door te botsen met neutronen worden snelle neutronen afgeremd tot thermische neutronen. Zo controleren ze de snelheid van de kernsplijtingsreactie en zorgen ze voor een stabiele werking van de reactor. Vroege kernreactoren hebben veel toepassingen. Maar grafiet verandert onder invloed van hoge temperaturen en neutronenbestraling, waardoor speciale technische maatregelen nodig zijn om langdurig veilig gebruik te garanderen.
Conclusie
Als allotroop van koolstof heeft grafiet verschillende eigenschappen en wordt het veel gebruikt. De verschillende eigenschappen zijn aan elkaar gerelateerd, wat de prestaties in verschillende scenario's bepaalt. Van alledaagse potloden tot industriële staalfabricage en batterijproductie tot hightech kernreactoren, grafiet is onmisbaar. Met de ontwikkeling van wetenschap en technologie heeft grafiet een groot potentieel in opkomende gebieden. En het zal een kritischere positie innemen in de materiaalkunde, mondiale hulpbronnenstrategie en duurzame ontwikkelingsstrategie. En het zal de vooruitgang van de menselijke samenleving blijven bevorderen.