O grafite, como um alótropo fundamental do carbono, desempenha um papel importante em muitos campos. A exploração aprofundada de sua estrutura é a chave para desbloquear o amplo potencial de aplicação do grafite e o desenvolvimento de novos materiais.
Índice
Alternar
O que é grafite?
O grafite, um mineral feito de átomos de carbono, é amplamente distribuído na natureza. Ele tem um brilho metálico e um toque macio e suave. Isso o torna um material ideal para as pontas de lápis. A cor do grafite é principalmente preta ou cinza escuro. E sua pureza e grau de cristalização variam de acordo com o ambiente de formação.
Estrutura atômica e molecular do grafite
Estrutura atômica do grafite
A composição principal do grafite é o carbono. Os átomos de carbono no grafite são conectados por ligações covalentes. E cada átomo de carbono e os três átomos de carbono circundantes formam uma estrutura de anel hexagonal estável, que se estende indefinidamente no plano para formar um esqueleto atômico sólido.
Estrutura molecular do grafite
Em nível molecular, o grafite é composto de camadas de átomos de carbono empilhados uns sobre os outros. Os átomos de carbono entre as camadas são mantidos por forças de van der Waals relativamente fracas. E essa estrutura em camadas explica por que o grafite tem excelente lubricidade e desliza facilmente entre as camadas.
Dois elementos-chave da estrutura do grafite
Estrutura cristalina hexagonal do grafite
Arranjos
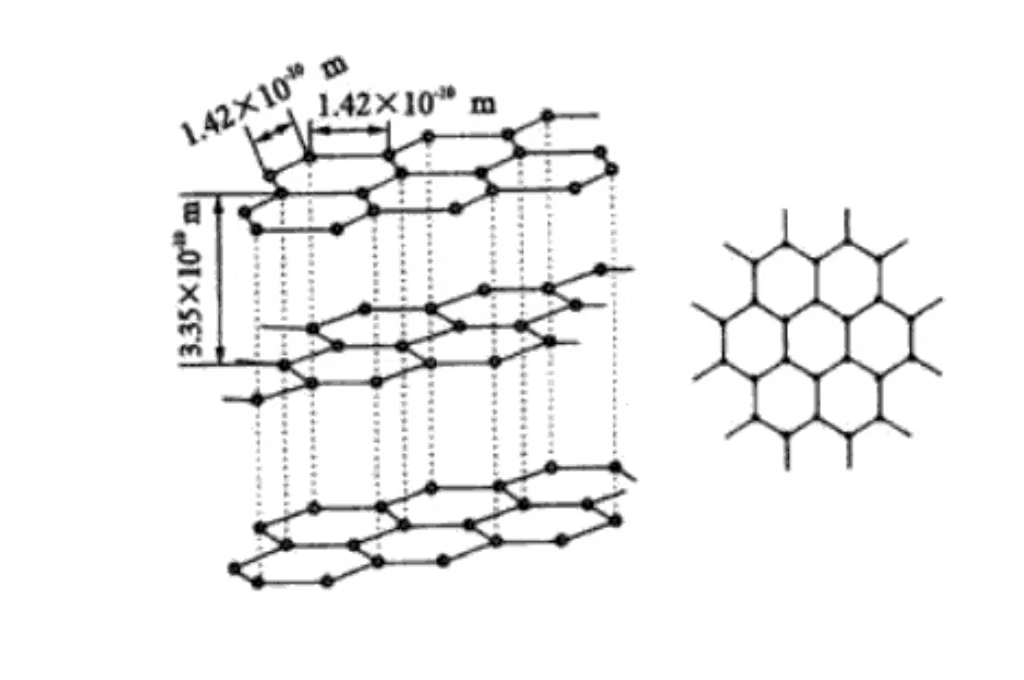
O grafite tem uma estrutura de cristal hexagonal, os átomos de carbono estão dispostos em hexágonos no plano, incluindo um ângulo de 120 graus. A disposição é regular e estável, propícia à condução de elétrons, e é a base de sua boa condutividade elétrica.
Camadas
Os átomos de carbono são empilhados em planos paralelos e o espaçamento entre as camadas é de cerca de 0,335 nm. E a força de van der Waals entre as camadas é fraca, o que faz com que o grafite deslize facilmente entre as camadas externas e tenha capacidade de lubrificação. Ele é comumente usado como lubrificante no campo da fabricação mecânica.
Camadas de estrutura cristalina
Cada camada de átomos de carbono forma um plano de rede por meio de ligações covalentes. Isso é organizado de maneira ordenada no espaço, dando as características cristalinas macroscópicas e a anisotropia do grafite. A forte ligação covalente na camada faz com que o grafite tenha alta resistência e dureza no plano. A direção do plano vertical tem baixa resistência devido à fraca força entre as camadas.
Ligações entre átomos de carbono
Forças de Van der Waal
Os átomos de carbono entre as camadas dependem da força de van der Waals, que é fraca, resultando em fácil separação por deslizamento entre as camadas de grafite e lubrificação. Mas isso também faz com que a estrutura entre camadas do grafite varie sob determinadas condições (como alta temperatura e pressão). Por exemplo, ela pode ser transformada em uma estrutura de diamante.
Separação de camadas
Devido à fraca força de van der Waals, a camada de grafite pode ser separada com a aplicação de uma pequena força de cisalhamento. Isso não só reflete a lubrificação, mas também cria a possibilidade de reações de intercalação, por meio das quais as propriedades físicas e químicas do grafite podem ser alteradas para preparar materiais compostos especiais. Por exemplo, materiais de eletrodo negativo para baterias de íons de lítio.
Ligações covalentes
Os átomos de carbono na camada são fortemente conectados por ligações covalentes para formar uma estrutura hexagonal estável. Isso determina a alta dureza e resistência do grafite no plano, garantindo sua estabilidade estrutural na aplicação de materiais de eletrodos. E limita o movimento dos elétrons, afetando a anisotropia no plano.
Hibridização Sp2
Ângulo de ligação
Os átomos de carbono adotam a hibridização sp2, um orbital 2s e dois orbitais 2p se hibridizam para formar três orbitais de hibridização sp2 equivalentes. Eles são distribuídos em um triângulo plano com um ângulo de aproximadamente 120 graus. Assim, os átomos de carbono formam ligações covalentes estáveis com três átomos de carbono adjacentes para construir uma estrutura hexagonal, o que favorece a condução da deslocalização de elétrons e a boa condutividade elétrica.
Átomos de carbono
O átomo de carbono constrói um esqueleto planar com três átomos de carbono circundantes por meio de orbitais híbridos sp2. E os planos verticais dos orbitais 2p não híbridos se sobrepõem para formar nuvens de elétrons π deslocalizadas. As nuvens de elétrons π dão ao grafite boa condutividade elétrica, na qual os elétrons podem se mover livremente em resposta a mudanças nos campos elétricos. E tornam o grafite ativo em reações químicas e participam de processos eletroquímicos. Por exemplo, como um meio de transferência de elétrons em baterias de íons de lítio.
Anisotropia
Atributos no plano e fora do plano
O grafite apresenta anisotropia significativa em diferentes direções. No plano, a ligação covalente é forte, com alta dureza, resistência e boa condutividade elétrica. Por exemplo, você pode usar materiais compostos reforçados com fibra de grafite como uma fase de reforço para usar sua resistência à tração no plano. Na direção do plano vertical, devido à fraca força de van der Waals entre as camadas, a resistência é baixa e a condutividade é ruim. Essa característica faz com que ele tenha uma vantagem específica em diferentes cenários de aplicação.
Acordos de energia atômica
Os átomos de carbono do grafite estão dispostos de acordo com uma lei específica, formando hexágonos no plano e camadas de empilhamento no espaço. Esse arranjo determina a estrutura cristalina e as propriedades físicas e químicas. A difração de raios X pode determinar a cristalinidade e os parâmetros estruturais de acordo com o padrão específico apresentado por seu arranjo ordenado. E a estabilidade do arranjo atômico faz com que o grafite mantenha um desempenho estável em uma determinada faixa de temperatura e pressão. Por exemplo, o grafite como material refratário em alta temperatura pode garantir a integridade da estrutura, fornecendo proteção para a confiabilidade das aplicações industriais.
Estrutura cristalina e de rede do grafite
Estrutura de rede do grafite
O grafite tem estrutura de rede hexagonal, os eixos a e b têm o mesmo comprimento. E o ângulo é de 120 graus, o eixo c é perpendicular ao plano do átomo de carbono. Seu comprimento reflete o arranjo periódico da estrutura em camadas, pertencente ao sistema de cristal hexagonal, com simetria e características cristalográficas específicas.
Estrutura cristalina do grafite
O cristal de grafite consiste em várias unidades de estrutura hexagonal dispostas de forma ordenada no espaço. E os átomos de carbono internos estão dispostos de forma altamente ordenada. E os defeitos e as impurezas alteram significativamente seu desempenho, afetando o transporte de elétrons e fônons, as reações químicas e a uniformidade do material.
Três defeitos comuns na estrutura do grafite
Os defeitos na estrutura do grafite têm grande influência em seu desempenho.
Defeitos pontuais, como átomos vagos e livres, destroem a integridade atômica e afetam a condução de elétrons e as propriedades mecânicas.
Os defeitos lineares, como o deslocamento, afetam a deformação plástica e a resistência.
Os defeitos de superfície, como os limites de grãos, impedem a transmissão de elétrons e fônons, reduzem a condutividade e a condutividade térmica. Além disso, levam facilmente a reações químicas e à agregação de impurezas.
Conceitos relacionados à estrutura do grafite
Estrutura de Lewis do grafite
A estrutura de Lewis do grafite mostra o compartilhamento de elétrons entre os átomos de carbono e satisfaz a estrutura estável de oito elétrons ao formar ligações covalentes com os átomos de carbono vizinhos. Os elétrons não envolvidos formam nuvens de elétrons π deslocalizadas. Isso fornece a base para a compreensão da ligação química e da distribuição de elétrons.
Hibridização de grafite
A hibridização sp2 dos átomos de carbono do grafite é a raiz de sua estrutura e propriedades exclusivas. Isso resulta em uma estrutura planar, uma nuvem de elétrons π deslocalizada, o que dá ao grafite uma variedade de excelentes propriedades.
Símbolos e fórmulas de grafite
O símbolo químico do grafite é "C". Embora seja difícil expressar a estrutura macromolecular com uma fórmula molecular simples, no cálculo químico e na fórmula da reação. O "C" pode representar a reação do grafite, refletindo a transformação e a conservação do carbono.
Estrutura e ligação do grafite
A estrutura em camadas e as propriedades de superfície do grafite são de grande importância para suas propriedades de ligação. A força de van der Waals entre camadas é fraca, portanto, é necessário modificar a superfície do grafite ou selecionar um aglutinante adequado para aumentar a interação. A modificação da superfície pode introduzir grupos funcionais ou tratamento de engrossamento. E os grupos polares do aglutinante podem se ligar fortemente aos átomos de carbono na superfície do grafite. Em materiais compostos, o bom desempenho da ligação é fundamental para garantir as propriedades mecânicas e funcionais gerais. E uma ligação ruim pode facilmente causar concentração de estresse interfacial, resultando em falha do material.
Explique a diferença entre a estrutura do grafite e a de outros materiais
Estrutura do grafite vs. estrutura do grafeno
De fato, grafeno representa uma camada de grafite com um átomo de espessura. Em cada folha de grafite de 1 mm de espessura, há cerca de 3 milhões de camadas de grafeno empilhadas umas sobre as outras. O grafeno pode ser considerado como uma camada de grafite, enquanto o grafite consiste em várias camadas de grafeno, uma sobre a outra.
Comparação da estrutura do grafite e do diamante
Diferenças estruturais
Os átomos de carbono do diamante adotam a hibridização sp3 para formar uma estrutura espacial tetraédrica, e as ligações covalentes entre os átomos são muito fortes. O grafite é hexagonal planar híbrido sp2 e em camadas, com forças de van der Waals fracas entre as camadas.
Diferenças de desempenho
As diferenças estruturais resultam em diferenças distintas de desempenho. A dureza do diamante é muito alta, usada em usinagem; a textura macia do grafite, boa lubrificação, é usada como lubrificante e grafite de lápis. O grafite conduz eletricidade, enquanto o diamante dificilmente. O diamante tem alto índice de refração e transparência, usado em joias; o grafite é preto e opaco.
Tipos de estrutura de grafite
Grafite natural
Ocorre normalmente em xisto grafitado, gnaisse grafitado, xisto com grafite e xisto metamórfico. De acordo com a forma de cristal, grafite natural pode ser dividido simultaneamente em duas variedades: grafite cristalino, que também é dividido em grafite em flocos e grafite criptocristalino, também conhecido como grafite terroso.
Grafite sintético
Grafite sintético é um tipo de produto químico. Seu principal ingrediente é o carbono. Ele é obtido por meio de pirólise em alta temperatura e grafitização de polímeros orgânicos.
Estruturas especiais de grafite, como grafite expansível e estruturas de nanografite. Grafite expansível por meio de tratamento especial, material de inserção entre camadas, decomposição e expansão em alta temperatura, com bom retardante de chamas, usado para materiais à prova de fogo. As estruturas de nanografite, como folhas de nanografite e fibras de nanografite, têm grande área de superfície específica, alta atividade de superfície e excelentes propriedades mecânicas. E tem grande potencial nos campos de armazenamento de energia, transportadores de catalisadores e materiais compostos de alto desempenho.
Correlação entre a estrutura e o uso do grafite
A estrutura exclusiva do grafite determina sua ampla utilização. A boa condutividade elétrica faz dele um material de eletrodo, que é usado em baterias e células eletrolíticas. A estabilidade em altas temperaturas e a inércia química o tornam um refratário para a indústria siderúrgica. A lubricidade permite que ele atue como um lubrificante na fabricação de máquinas. No campo aeroespacial, os compostos de grafite são usados na fabricação de componentes de aeronaves e foguetes devido à sua baixa densidade, alta resistência e estabilidade térmica. Além disso, o grafite também desempenha um papel importante na fabricação de lápis, na preparação de grafeno e em outros campos. E cada aplicação está intimamente ligada à estrutura do grafite.
Conclusão
A estrutura do grafite mostra sua singularidade e complexidade em várias dimensões, o que afeta profundamente o desempenho e a aplicação. A pesquisa aprofundada e a compreensão da estrutura do grafite abrem amplas perspectivas para sua aplicação inovadora em muitos campos, como ciência dos materiais e energia. E isso ajuda a superar os problemas de material e energia da sociedade moderna.