Grafit, sebagai salah satu alotrop karbon utama, memainkan peran penting dalam banyak bidang. Eksplorasi mendalam terhadap strukturnya adalah kunci untuk membuka potensi aplikasi grafit yang luas dan pengembangan material baru.
Daftar Isi
Beralih
Apa itu grafit?
Grafit, mineral yang terbuat dari atom karbon, tersebar luas di alam. Grafit memiliki kilau metalik dan kesan lembut serta halus. Hal ini membuatnya sebagai bahan yang ideal untuk ujung pensil. Warna grafit sebagian besar hitam atau abu-abu gelap. Dan tingkat kemurnian serta derajat kristalisasinya bervariasi menurut lingkungan pembentukannya.
Struktur atom dan molekul grafit
Struktur atom grafit
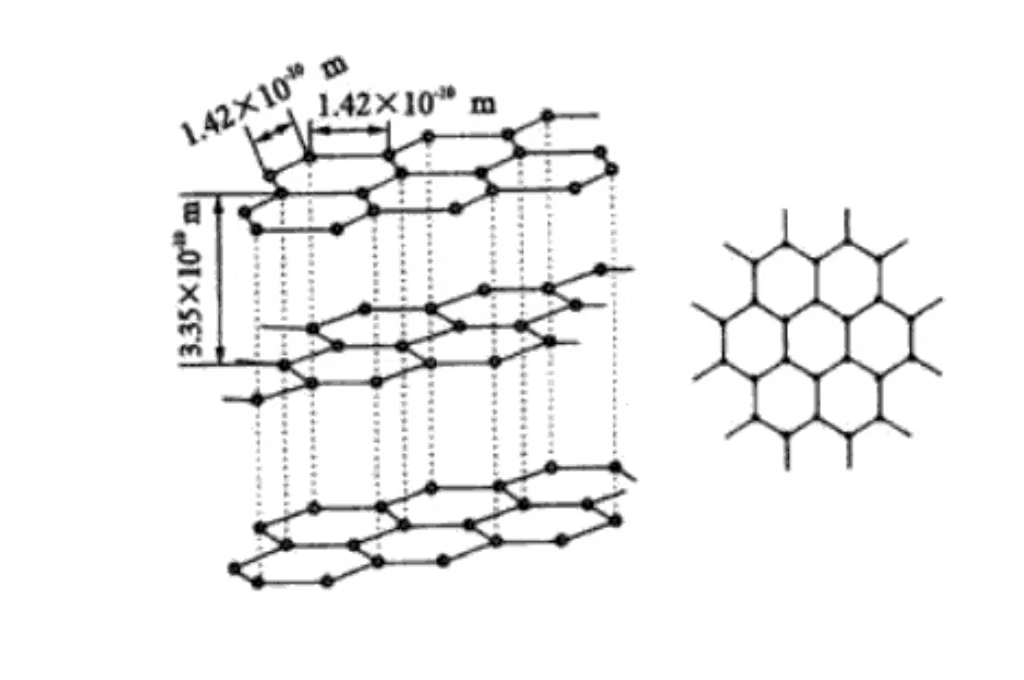
Komposisi utama grafit adalah karbon. Atom karbon dalam grafit dihubungkan oleh ikatan kovalen. Dan setiap atom karbon dan tiga atom karbon di sekitarnya membentuk struktur cincin heksagonal yang stabil, yang memanjang tanpa batas pada bidang untuk membentuk kerangka atom yang kokoh.
Struktur molekul grafit
Pada tingkat molekuler, grafit terdiri dari lapisan atom karbon yang ditumpuk di atas satu sama lain. Atom karbon antar lapisan dipertahankan oleh gaya van der Waals yang relatif lemah. Dan struktur berlapis ini menjelaskan mengapa grafit memiliki pelumasan yang sangat baik dan mudah meluncur di antara lapisan.
Dua elemen kunci dari struktur grafit
Struktur kristal heksagonal grafit
Pengaturan
Grafit memiliki struktur kristal heksagonal, atom karbon tersusun rapat dalam segi enam dalam bidang, termasuk sudut 120 derajat. Susunan yang teratur dan stabil, kondusif untuk konduksi elektron, merupakan dasar konduktivitas listriknya yang baik.
Pelapisan
Atom karbon ditumpuk pada bidang paralel, jarak lapisan sekitar 0,335nm. Dan gaya van der Waals di antara lapisan-lapisan itu lemah, yang membuat grafit mudah bergeser di antara lapisan-lapisan eksternal dan memiliki kemampuan pelumasan. Ini biasanya digunakan sebagai pelumas di bidang manufaktur mekanis.
Lapisan struktur kristal
Setiap lapisan atom karbon membentuk bidang jaringan melalui ikatan kovalen. Hal ini tersusun secara teratur di dalam ruang, memberikan karakteristik kristal makroskopis dan anisotropi grafit. Ikatan kovalen yang kuat pada lapisan membuat grafit memiliki kekuatan dan kekerasan yang tinggi pada bidangnya. Arah bidang vertikal memiliki kekuatan yang rendah karena gaya antar lapisan yang lemah.
Ikatan dalam atom karbon
Pasukan Van der Waal
Atom karbon interlayer bergantung pada gaya van der Waals, yang lemah, sehingga mengakibatkan pemisahan geser yang mudah di antara lapisan grafit dan pelumasan. Tetapi, hal ini juga membuat struktur interlayer grafit berubah-ubah dalam kondisi tertentu (seperti suhu dan tekanan tinggi). Seperti dapat diubah menjadi struktur berlian.
Pemisahan lapisan
Karena gaya van der Waals yang lemah, lapisan grafit dapat dipisahkan dengan menerapkan gaya geser yang kecil. Hal ini tidak hanya mencerminkan pelumasan, tetapi juga menciptakan kemungkinan reaksi interkalasi, di mana sifat fisik dan kimia grafit dapat diubah untuk menyiapkan bahan komposit khusus. Misalnya, bahan elektroda negatif untuk baterai lithium-ion.
Ikatan kovalen
Atom karbon dalam lapisan terhubung erat oleh ikatan kovalen untuk membentuk struktur heksagonal yang stabil. Hal ini menentukan kekerasan dan kekuatan grafit yang tinggi pada bidang, menjamin stabilitas strukturalnya dalam penerapan bahan elektroda. Dan ini membatasi pergerakan elektron, yang memengaruhi anisotropi di bidang tersebut.
Hibridisasi Sp2
Sudut Ikatan
Atom karbon mengadopsi hibridisasi sp2, satu orbital 2s dan dua orbital 2p berhibridisasi untuk membentuk tiga orbital hibridisasi sp2 yang setara. Ini didistribusikan dalam segitiga bidang dengan sudut sekitar 120 derajat. Sehingga atom karbon membentuk ikatan kovalen yang stabil dengan tiga atom karbon yang berdekatan untuk membangun struktur heksagonal, yang kondusif untuk konduksi delokalisasi elektron dan konduktivitas listrik yang baik.
Atom karbon
Atom karbon membangun kerangka planar dengan tiga atom karbon di sekelilingnya melalui orbital hibrida sp2. Dan bidang vertikal orbital 2p non-hibrida saling tumpang tindih untuk membentuk awan π-elektron yang terdelokalisasi. Awan π-elektron memberikan konduktivitas listrik yang baik pada grafit, di mana elektron dapat bergerak secara bebas sebagai respons terhadap perubahan medan listrik. Dan membuat grafit aktif dalam reaksi kimia dan berpartisipasi dalam proses elektrokimia. Seperti sebagai media transfer elektron pada baterai lithium-ion.
Anisotropi
Atribut di dalam pesawat dan atribut di luar pesawat
Grafit menunjukkan anisotropi yang signifikan pada arah yang berbeda. Di dalam bidang, ikatan kovalennya kuat, dengan kekerasan, kekuatan dan konduktivitas listrik yang baik. Misalnya, Anda dapat menggunakan bahan komposit yang diperkuat serat grafit sebagai fase penguat untuk menggunakan kekuatan tarik dalam bidang. Pada arah bidang vertikal, karena gaya van der Waals antar lapisan yang lemah, kekuatannya rendah dan konduktivitasnya buruk. Karakteristik ini membuatnya menjadi keuntungan yang ditargetkan dalam skenario aplikasi yang berbeda.
Pengaturan Energi Atom
Atom karbon grafit disusun menurut hukum tertentu, membentuk segi enam pada bidang dan menumpuk lapisan dalam ruang. Susunan ini menentukan struktur kristal serta sifat fisik dan kimianya. Difraksi sinar-X dapat menentukan kristalinitas dan parameter struktural menurut pola spesifik yang disajikan oleh susunannya yang teratur. Dan kestabilan susunan atom membuat grafit mempertahankan kinerja yang stabil dalam kisaran suhu dan tekanan tertentu. Seperti grafit sebagai bahan tahan api pada suhu tinggi dapat memastikan integritas struktur, memberikan perlindungan untuk keandalan aplikasi industri.
Kisi dan struktur kristal grafit
Struktur kisi grafit
Grafit memiliki struktur kisi heksagonal, sumbu a dan sumbu b memiliki panjang yang sama. Dan sudutnya 120 derajat, sumbu c tegak lurus dengan bidang atom karbon. Panjangnya mencerminkan susunan periodik dari struktur berlapis, termasuk dalam sistem kristal heksagonal, dengan simetri dan karakteristik kristalografi tertentu.
Struktur kristal grafit
Kristal grafit terdiri atas banyak unit kisi heksagonal yang tersusun secara teratur dalam ruang. Dan atom karbon internal disusun dengan cara yang sangat teratur. Cacat dan ketidakmurnian akan mengubah kinerjanya secara signifikan, memengaruhi transpor elektron dan fonon, reaksi kimia, dan keseragaman material.
Tiga cacat umum dalam struktur grafit
Cacat pada struktur grafit memiliki pengaruh besar pada performanya.
Cacat titik, seperti kekosongan dan jarak atom, akan merusak integritas atom dan memengaruhi konduksi elektron serta sifat mekanis.
Cacat linier seperti dislokasi mempengaruhi deformasi dan kekuatan plastis.
Cacat permukaan, seperti batas butir, menghambat transmisi elektron dan fonon, mengurangi konduktivitas dan konduktivitas termal. Dan dengan mudah menyebabkan reaksi kimia dan agregasi pengotor.
Konsep-konsep terkait struktur grafit
Struktur Lewis grafit
Struktur Lewis grafit menunjukkan pembagian elektron di antara atom karbon, dan memenuhi struktur stabil delapan elektron dengan membentuk ikatan kovalen dengan atom karbon yang berdekatan. Elektron yang tidak terlibat membentuk awan elektron π yang terdelokalisasi. Hal ini menjadi dasar untuk memahami ikatan kimia dan distribusi elektron.
Hibridisasi grafit
Hibridisasi sp2 dari atom karbon grafit adalah akar dari struktur dan sifatnya yang unik. Hal ini menghasilkan struktur planar, awan π-elektron yang terdelokalisasi, memberikan grafit berbagai sifat yang sangat baik.
Simbol dan rumus grafit
Simbol kimia grafit adalah "C". Meskipun sulit untuk mengekspresikan struktur makromolekul dengan rumus molekul yang sederhana, tetapi dalam perhitungan kimia dan rumus reaksi. "C" dapat merepresentasikan reaksi grafit, yang mencerminkan transformasi dan konservasi karbon.
Struktur dan ikatan grafit
Struktur berlapis dan sifat permukaan grafit sangat penting bagi sifat ikatannya. Gaya van der Waals antar lapisan lemah, sehingga perlu untuk memodifikasi permukaan grafit atau memilih pengikat yang sesuai untuk meningkatkan interaksi. Modifikasi permukaan dapat memperkenalkan gugus fungsi atau perlakuan kasar. Dan gugus polar pengikat dapat berikatan kuat dengan atom karbon pada permukaan grafit. Dalam material komposit, kinerja ikatan yang baik adalah kunci untuk menjamin sifat mekanik dan fungsional secara keseluruhan. Dan ikatan yang buruk mudah menyebabkan konsentrasi tegangan antarmuka, yang mengakibatkan kegagalan material.
Jelaskan Perbedaan Struktur Grafit dan Material Lainnya
Struktur Grafit vs Struktur Graphene
Sebenarnya, graphene merupakan lapisan grafit setebal satu atom. Dalam setiap lembar grafit setebal 1 mm, terdapat sekitar 3 juta lapisan graphene yang ditumpuk satu sama lain. Graphene dapat dianggap sebagai satu lapisan grafit sedangkan grafit terdiri dari beberapa lapisan graphene di atas satu sama lain.
Perbandingan struktur grafit dan berlian
Perbedaan struktural
Atom karbon berlian mengadopsi hibridisasi sp3 untuk membentuk struktur ruang tetrahedral, dan ikatan kovalen antar atom sangat kuat. Grafit adalah hibrida sp2 planar heksagonal dan berlapis-lapis, dengan gaya van der Waals yang lemah di antara lapisan.
Perbedaan kinerja
Perbedaan struktural menghasilkan perbedaan performa yang berbeda. Kekerasan berlian sangat tinggi, digunakan dalam permesinan; Tekstur grafit yang lembut, pelumasan yang baik, digunakan sebagai pelumas dan ujung pensil. Grafit menghantarkan listrik, berlian tidak. Berlian dengan indeks bias dan transparansi yang tinggi, digunakan dalam perhiasan; Grafit berwarna hitam dan buram.
Jenis-jenis struktur grafit
Grafit Alami
Biasanya terjadi pada sekis grafit, gneiss grafit, sekis yang mengandung grafit, dan serpih metamorf. Menurut bentuk kristal, grafit alami secara bersamaan dapat dibagi menjadi dua jenis: grafit kristal-yang selanjutnya dibagi lagi menjadi grafit serpihan dan grafit kriptokristalin, yang juga dikenal sebagai grafit tanah.
Grafit Sintetis
Grafit sintetis adalah sejenis produk kimia. Bahan utamanya adalah karbon. Ini diperoleh melalui pirolisis suhu tinggi dan grafitisasi polimer organik.
Struktur grafit khusus seperti grafit yang dapat diperluas dan struktur nanografit. Grafit yang dapat diperluas dengan perlakuan khusus, bahan sisipan interlayer, dekomposisi dan ekspansi pada suhu tinggi, dengan penghambat api yang baik, digunakan untuk bahan tahan api. Struktur grafit nano, seperti lembaran grafit nano dan serat grafit nano, memiliki luas permukaan spesifik yang besar, aktivitas permukaan yang tinggi, dan sifat mekanik yang sangat baik. Dan memiliki potensi besar di bidang penyimpanan energi, pembawa katalis, dan material komposit berkinerja tinggi.
Korelasi antara struktur grafit dan penggunaan
Struktur grafit yang unik menentukan penggunaannya secara luas. Konduktivitas listrik yang baik menjadikannya bahan elektroda, yang digunakan dalam baterai dan sel elektrolit. Stabilitas suhu tinggi dan kelembaman kimiawi membuatnya menjadi bahan tahan api untuk industri baja. Pelumasan memungkinkannya untuk bertindak sebagai pelumas dalam pembuatan mesin. Di bidang kedirgantaraan, komposit grafit digunakan dalam pembuatan komponen pesawat terbang dan roket karena kepadatannya yang rendah, kekuatannya yang tinggi, dan stabilitas termalnya. Selain itu, grafit juga berperan penting dalam pembuatan pensil, pembuatan graphene, dan bidang lainnya. Dan setiap aplikasi terkait erat dengan struktur grafit.
Kesimpulan
Struktur grafit menunjukkan keunikan dan kompleksitasnya dari berbagai dimensi, yang sangat memengaruhi kinerja dan aplikasinya. Penelitian dan pemahaman mendalam tentang struktur grafit membuka prospek yang luas untuk aplikasi inovatif di berbagai bidang seperti ilmu material dan energi. Dan ini membantu mengatasi masalah material dan energi dalam masyarakat modern.