Le graphite, allotrope du carbone, apparaît fréquemment dans la vie quotidienne et dans la production industrielle. Qu'est-ce que le graphite ? S'agit-il d'un métal, d'un minéral ou d'un élément ? De quoi est-il fait ? Cet article explore en profondeur la nature du graphite et dévoile ses secrets. Il met en évidence le charme unique et la valeur importante du graphite dans le domaine de la science et des applications.
Table des matières
ToggleDéfinition du graphite
Le graphite est une forme cristalline du carbone, qui présente généralement un état solide gris-noir et opaque, avec un éclat métallique unique. Mais il existe parfois une autre forme, la forme amorphe, qui consiste en des arrangements irréguliers d'atomes de graphite. Sa texture est relativement souple, cette souplesse lui permet de laisser des marques claires sur le papier. Cette propriété fait également du graphite le principal composant de la mine de crayon. D'un point de vue chimique, le graphite appartient à l'allotrope du carbone, qui est composé d'atomes de carbone comme le diamant, le fullerène et d'autres substances. Toutefois, la façon dont les atomes de carbone sont disposés dans ces substances est très différente, ce qui entraîne d'énormes différences dans leurs propriétés physiques et chimiques.
Le graphite est-il un métal ou un minéral ?
Le graphite n'est pas un métal, mais un minéral. Les métaux ont généralement une bonne conductivité électrique, une bonne conductivité thermique, une bonne ductilité et d'autres caractéristiques typiques. Bien que le graphite ait un certain degré de conductivité électrique et thermique, il n'a pas la ductilité caractéristique des métaux. Le graphite est un produit naturel issu de processus géologiques complexes et répond à la définition d'un minéral. Il existe dans des roches et des gisements spécifiques de la nature. Il s'agit d'une forme importante de carbone dans le long cycle et le processus d'évolution du cercle terrestre, témoin du mouvement et du changement des matériaux à l'intérieur de la terre.
Le graphite est-il un élément ?
Le graphite n'est pas un élément, mais une substance unique composée de carbone. Un élément est un groupe d'atomes ayant le même nombre de charges nucléaires (protons). Le graphite est une entité matérielle formée d'un grand nombre d'atomes de carbone liés entre eux par des liaisons chimiques spécifiques. Cette substance pure composée des mêmes éléments est appelée élémentaire. Le graphite est une forme particulière d'existence du carbone élémentaire. Sa structure cristalline unique et ses propriétés physiques et chimiques témoignent de la richesse et de la diversité des propriétés du carbone.
Le graphite est-il du carbone ?
Le graphite est un allotrope du carbone, entièrement composé de l'élément carbone. À l'intérieur du graphite, les atomes de carbone sont disposés et combinés d'une manière très particulière pour former une structure cristalline unique. Cette structure confère au graphite de nombreuses propriétés particulières. C'est pourquoi son apparence et ses propriétés physiques et chimiques sont très différentes de celles d'autres allotropes du carbone tels que le diamant (connu pour ses propriétés de dureté et de transparence) et le fullerène (doté d'une structure sphérique ou tubulaire unique). Dans de nombreux domaines, ils jouent des rôles différents.
D'où vient le graphite ?
Sources naturelles
Les sources naturelles de graphite dans la nature sont plus étendues. Une partie du graphite se trouve dans les roches métamorphiques. Par exemple, dans le processus de métamorphisme régional, les sédiments originaux contenant du carbone (tels que les veines de charbon) sont progressivement transformés en graphite par une cristallisation métamorphique complexe dans des conditions extrêmes de température et de pression élevées. En outre, certains graphites proviennent de roches magmatiques. Lorsque le magma envahit la croûte, le carbone qu'il contient cristallise dans un environnement géologique et des conditions physiques et chimiques spécifiques. Il forme ainsi le graphite. Les gisements de graphite naturel sont répartis dans de nombreux pays et régions du monde, parmi lesquels la Chine, le Brésil, l'Inde et d'autres pays disposent de ressources naturelles en graphite relativement riches. Ces ressources constituent une base matérielle importante pour le développement des industries mondiales liées au graphite.
Graphite artificiel
Avec le développement rapide des technologies industrielles modernes, la production de graphite artificiel est progressivement devenue une part importante de l'approvisionnement en graphite. Le graphite artificiel est généralement produit par un traitement thermique à haute température de matières premières spécifiques contenant du carbone (telles que le coke de pétrole, le coke d'asphalte, etc.). Il convertit amorphe Le carbone est transformé en graphite. À haute température, les éléments non carbonés de ces matières premières contenant du carbone se volatilisent progressivement. Les atomes de carbone se réarrangent et se cristallisent, pour finalement former du graphite artificiel dont la structure est similaire à celle du graphite naturel. La production de graphite artificiel est très contrôlable. Il est possible de contrôler avec précision sa pureté, sa structure cristalline et ses propriétés physiques et chimiques en fonction des besoins des différentes applications industrielles. Il est donc largement utilisé dans de nombreux domaines tels que l'acier, les batteries, les réfractaires, etc. Il apporte un soutien solide au développement de l'industrie moderne.
Types de graphite
En résumé, le graphite peut être principalement divisé en deux types : le graphite naturel et le graphite synthétique.
Graphite naturel
Le graphite naturel comprend également le graphite en paillettes, le graphite cristallin et le graphite cryptocristallin.
Le graphite lamellaire se caractérise par une forme de flocon large et mince, avec une large gamme de diamètres, allant de quelques dixièmes de millimètres à plusieurs millimètres. Ces écailles présentent une bonne conductivité électrique et thermique dans le sens du plan, tandis que leur structure en couches leur confère d'excellentes propriétés lubrifiantes.
Les cristaux de graphite cristallin sont bien développés et présentent une forme cristalline lamellaire hexagonale évidente. Les échelles sont relativement grandes et le diamètre des tranches est souvent supérieur à 0,1-0,2 mm. Ce type de graphite n'est pas abondant dans la nature. Mais en raison de son excellente structure cristalline et de ses propriétés uniques, il joue un rôle dans de nombreux domaines industriels de pointe.
Le cristal de graphite aphanitique est très petit et existe sous forme d'agrégats microcristallins. La forme spécifique du cristal peut difficilement être distinguée à l'œil nu. Sa teneur en carbone fixe est élevée, de l'ordre de 60%-80%. Dans les applications industrielles, le graphite cryptocristallin peut être utilisé comme matériau de coulée et matériau réfractaire.
Graphite synthétique
Il existe trois types de graphite synthétique, chacun ayant des propriétés et des utilisations uniques.
La pureté du graphite de haute pureté est extrêmement élevée, la teneur en impuretés est très faible, généralement supérieure à 99,9%. Son excellente stabilité chimique et sa conductivité électrique élevée lui confèrent un rôle clé dans la fabrication des semi-conducteurs, l'industrie chimique haut de gamme et d'autres industries ayant des exigences strictes en matière de pureté.
Le graphite pressé isostatiquement est formé par un processus de pressage isostatique et présente les caractéristiques d'une structure uniforme et d'une isotropie. Il présente une excellente résistance mécanique, une résistance aux températures élevées et aux chocs thermiques, ainsi que d'excellentes performances dans les domaines de la métallurgie, de l'électroérosion et autres.
Le graphite expansé est fabriqué à partir de graphite naturel par un traitement spécial, avec une structure vermiforme unique. Il peut se dilater rapidement à haute température pour former un matériau doté d'excellentes propriétés d'isolation thermique et d'étanchéité. Dans le domaine des matériaux ignifuges, le graphite expansé peut être utilisé pour fabriquer des joints ignifuges, des revêtements ignifuges, etc. Il peut empêcher efficacement la propagation du feu.
De quoi est fait le graphite ?
Élément de graphite
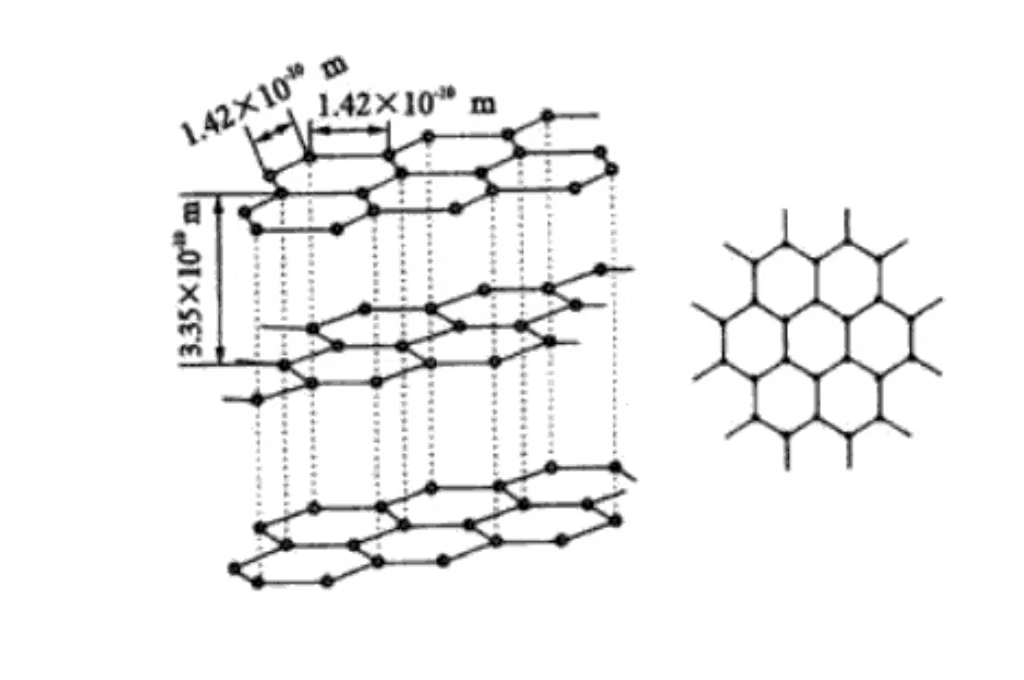
Le principal élément constitutif du graphite est le carbone. Dans le graphite, les atomes de carbone sont reliés entre eux par des liaisons covalentes, formant un réseau planaire d'hexagones. Ces structures planaires sont empilées couche par couche dans l'espace, formant la structure cristalline unique du graphite. Chaque atome de carbone forme une liaison covalente avec trois atomes de carbone environnants. La présence de cette liaison covalente confère au graphite une grande stabilité et une grande solidité au sein de la couche. Elle est également à l'origine de certaines de ses propriétés particulières, telles que la conductivité électrique et thermique.
La formule chimique du graphite
La formule chimique du graphite est généralement désignée par C, ce qui indique clairement qu'il est entièrement composé de carbone. Malgré sa formule chimique simple, le graphite présente des propriétés physiques et chimiques complexes et variées. Cela est dû à l'arrangement unique des atomes de carbone et à l'existence de nombreuses formes de liaisons chimiques. Cette caractéristique, qui fait que le graphite est composé d'un seul élément mais qu'il possède de nombreuses propriétés, lui confère une position unique dans le domaine de la science des matériaux. Il fait également l'objet de nombreuses recherches et utilisations.
Structure du graphite
Carbone Disposition des atomes de carbone dans le graphite
Le carbone est présent dans la microstructure du graphite. Les atomes de carbone présentent une caractéristique remarquable : ils sont disposés en couches. Chaque couche d'atomes de carbone est étroitement agencée pour former une énorme structure hexagonale planaire. Les atomes de carbone sont étroitement liés par des liaisons covalentes. Cela confère à ces couches planes une stabilité et une solidité élevées, et leur permet de résister sans dommage à un certain degré de force extérieure. La couche entre les couches est soumise à la faible interaction de la force de van der Waals. Cette force intercouche relativement faible permet au graphite entre la couche et la couche de glisser facilement sous l'effet d'une faible force externe, ce qui confère au graphite une bonne lubrification et une bonne flexibilité. Le graphite doit donc réduire la friction et avoir une certaine capacité de déformation dans le scénario d'application.
Collage
La liaison covalente entre les atomes de carbone dans la couche de graphite est une liaison chimique forte. Elle assure non seulement la stabilité et l'intégrité de la couche de graphite, mais a également un impact profond sur les propriétés physiques du graphite. En raison de l'existence de liaisons covalentes, les électrons peuvent se déplacer relativement librement entre les atomes de carbone de la couche. Cela permet au graphite d'avoir une bonne conductivité thermique à l'intérieur de la couche et de transférer efficacement le courant et la chaleur.
La force de van der Waals entre les couches est relativement faible. Et sa contribution aux propriétés physiques du graphite, telles que la dureté et la densité, est plus faible que celle des liaisons covalentes. Cet effet synergique des liaisons covalentes intra-couches et des forces de van der Waals inter-couches est à l'origine des propriétés anisotropes uniques du graphite. En d'autres termes, les propriétés physiques et chimiques du graphite dans la direction de la couche et de la couche verticale sont sensiblement différentes. Cette propriété doit être pleinement prise en compte dans les applications des matériaux afin d'optimiser l'utilisation des propriétés du graphite.
Propriétés du graphite
Propriétés physiques
Couleur
Le graphite présente généralement une couleur d'apparence gris-noir. La formation de cette couleur est étroitement liée à la structure électronique interne du graphite et à ses caractéristiques d'absorption et de réflexion de la lumière. Les atomes de carbone du graphite absorbent et diffusent la lumière visible grâce à des liaisons chimiques spécifiques et à la distribution des nuages d'électrons. Ainsi, la majeure partie de la lumière visible est absorbée, et seule une petite quantité de lumière est réfléchie ou diffusée. Il en résulte un effet visuel gris-noir au niveau macro. En outre, la nature opaque du graphite lui confère également une texture unique, qui contraste fortement avec d'autres matériaux transparents ou translucides.
Densité
La densité du graphite est relativement faible, entre 2,09 et 2,23 g/cm 3. La gravité spécifique est également faible. Cette caractéristique confère au graphite un avantage certain dans certains scénarios d'application soumis à des exigences strictes en matière de poids. Par exemple, dans la conception de certains composants dans le domaine aérospatial, il est nécessaire d'utiliser des matériaux qui ont un certain degré de conductivité et de lubrification, mais qui peuvent également réduire le poids total. Le graphite devient alors un matériau candidat très potentiel.
Point de fusion
Le graphite a un point de fusion très élevé, d'environ 3652°C -3697 °C. Cette excellente stabilité à haute température permet au graphite de conserver sa structure et ses propriétés relativement stables dans des environnements à très haute température. Le graphite joue un rôle essentiel dans la fusion du fer et de l'acier, les matériaux réfractaires et d'autres processus industriels à haute température.
Conductivité électrique
Le graphite présente une excellente conductivité électrique dans la couche, qui est due à la formation d'une structure stable de nuage d'électrons entre les atomes de carbone de la couche par le biais de liaisons covalentes. Les électrons peuvent se déplacer relativement librement dans cette structure, ce qui permet une conduction efficace du courant. Parallèlement, la conductivité thermique du graphite est également très bonne et il peut transférer la chaleur rapidement.
Lubrification
Les propriétés lubrifiantes du graphite lubrifiant sont dues à sa structure unique en couches. La force de van der Waals entre les couches étant faible, lorsque le graphite est soumis à une force extérieure, le glissement relatif entre les couches se produit facilement. Lorsque le graphite est soumis à une force externe, le glissement relatif entre les couches se produit facilement. Ce processus de glissement peut réduire efficacement le coefficient de frottement et jouer ainsi un bon rôle de lubrification. Qu'il s'agisse de la lubrification quotidienne de divers équipements mécaniques dans l'industrie des machines, ou des besoins de lubrification dans certains environnements spéciaux (tels que les hautes températures, les hautes pressions ou les environnements de corrosion chimique), le graphite peut avoir d'excellents effets de lubrification.
Propriétés chimiques
Résistance à la corrosion du graphite
Le graphite présente une bonne résistance aux acides et aux alcalis. Il peut conserver une structure et des performances relativement stables dans les solutions acides et alcalines dans une certaine plage de concentration. Cela s'explique par le fait que les atomes de carbone du graphite forment une structure d'énergie chimique stable par le biais de liaisons covalentes. Le graphite est donc difficile à détruire par les ions des solutions acides et basiques. Cette résistance à l'acide et à l'alcali confère au graphite une valeur d'application importante dans certains environnements corrosifs de l'industrie chimique.
Réactivité avec d'autres matériaux
Dans des conditions de température normales, les propriétés chimiques du graphite sont relativement stables. Il n'est pas facile de réagir chimiquement avec la plupart des substances courantes. Toutefois, lorsqu'il est exposé à une température élevée, à une pression élevée ou à un environnement chimique spécifique, le graphite peut réagir avec certains oxydants (tels que l'oxygène, l'acide sulfurique concentré, etc.)
Par exemple, lorsque l'oxygène est suffisant et que la température augmente dans une certaine mesure, le graphite subit une réaction d'oxydation et se transforme progressivement en produits tels que le dioxyde de carbone. Cette réactivité limite dans une certaine mesure l'application du graphite dans certains environnements d'oxydation extrême. Mais elle offre également la possibilité d'un traitement spécial et d'une modification du graphite.
Coefficient de dilatation thermique
Le graphite a un faible coefficient de dilatation thermique, ce qui lui confère une bonne stabilité dimensionnelle en cas de changement de température. Comparé à de nombreux autres matériaux, le volume du graphite change très peu lors d'une augmentation ou d'une diminution importante de la température.
Dans certaines applications exigeant une grande précision dimensionnelle des matériaux, le faible coefficient de dilatation thermique du graphite est particulièrement important. Il permet d'éviter efficacement les problèmes tels que la déformation des composants et la réduction de la précision de l'assemblage causée par les fluctuations de température. Il permet ainsi de garantir le fonctionnement normal et la stabilité des performances des équipements ou des instruments dans des environnements de températures différentes.
Oxydation
Bien que le graphite présente une forte résistance à l'oxydation et à la corrosion à température ambiante, dans des conditions extrêmes telles qu'une température élevée, une forte humidité ou un environnement fortement oxydé, le graphite s'oxyde et se corrode progressivement. Par exemple, en cas d'exposition prolongée à des températures élevées dans l'air, les atomes de carbone à la surface du graphite réagissent avec l'oxygène pour former une couche d'oxyde.
Au fil du temps, l'épaississement continu de la couche d'oxyde entraîne des modifications de la structure et des performances du graphite. La conductivité et la résistance s'en trouveront réduites. Par conséquent, dans certains domaines d'application où les exigences en matière de résistance à l'oxydation du graphite sont élevées, il est souvent nécessaire de procéder à un traitement de surface spécial du graphite. Ou d'ajouter des antioxydants et d'autres mesures. L'amélioration de la capacité antioxydante permet de garantir la stabilité des performances et la fiabilité des matériaux en graphite pendant leur utilisation.
Propriétés mécaniques
Dureté et résistance
La résistance et la dureté du graphite sont relativement faibles, et sa dureté Mohs est d'environ 1-2. Cette propriété rend le graphite relativement facile à façonner et à transformer en diverses formes au cours du traitement. Par exemple, dans la fabrication des mines de crayon, en mélangeant le graphite et d'autres matériaux tels que l'argile dans différentes proportions et en les pressant, il est facile de fabriquer des mines de crayon avec différents niveaux de dureté pour répondre à différents besoins d'écriture. Cependant, bien que la résistance globale du graphite soit faible, il possède encore une certaine valeur d'utilisation de la résistance dans certaines directions spécifiques. Par exemple, dans la direction de la couche de graphite.
Élasticité
En raison de sa structure unique en couches, le graphite présente une certaine flexibilité et élasticité. Lorsqu'il est soumis à une petite force extérieure, le graphite peut se plier et se déformer jusqu'à un certain point. Lorsque la force extérieure est supprimée, le graphite peut reprendre sa forme initiale ou une forme proche de la forme initiale. Cette flexibilité et cette élasticité font du graphite une perspective d'application potentielle dans certains dispositifs électroniques flexibles, matériaux d'étanchéité et autres domaines émergents.
Anisotropie
Le graphite anisotrope présente des caractéristiques anisotropes extrêmement évidentes. En d'autres termes, ses propriétés physiques et chimiques sont sensiblement différentes selon les directions. En termes de propriétés conductrices, la conductivité le long de la couche de graphite est beaucoup plus élevée que la conductivité dans la couche verticale. Cela s'explique par le fait que les liaisons covalentes favorisent la conduction des électrons et que la force de van der Waals entre les couches entrave la conduction des électrons.
En termes de dureté et de résistance, la dureté et la résistance de la couche verticale sont relativement élevées. La force de van der Waals entre les couches limite dans une certaine mesure le glissement relatif entre les couches. En revanche, le glissement et la déformation sont plus susceptibles de se produire en raison de la faible force entre les couches. Cette caractéristique anisotrope doit faire l'objet d'une attention particulière et être prise en compte dans le processus d'application du graphite. En fonction des exigences spécifiques de l'application, il est raisonnable de sélectionner et d'utiliser les avantages des propriétés du graphite dans différentes directions. Cela permet de maximiser l'utilisation des performances du matériau graphite et d'optimiser l'effet de l'application.
Propriétés thermiques et électriques
Il existe une relation interne étroite entre les propriétés thermiques et électriques du graphite et les propriétés thermiques et d'excellentes performances. Sa conductivité thermique élevée lui permet d'émettre rapidement de la chaleur, ce qui présente une grande valeur d'application dans le domaine de la dissipation thermique des équipements électroniques. Parallèlement, la bonne conductivité du graphite lui permet de transmettre efficacement le courant en tant qu'excellent conducteur dans le circuit.
Autres propriétés
Outre les nombreuses propriétés mentionnées ci-dessus, le graphite possède d'autres propriétés particulières. Par exemple, le graphite possède certaines propriétés d'adsorption. Sa riche structure poreuse et sa grande surface spécifique peuvent absorber certains gaz et petites molécules. Cette caractéristique a une valeur d'application potentielle dans la purification des gaz et le traitement des eaux usées dans le domaine de la protection de l'environnement. Une modification et un traitement appropriés du graphite permettent d'améliorer encore ses performances en matière d'adsorption. Il peut être utilisé pour éliminer les gaz nocifs dans l'air (tels que le formaldéhyde, le dioxyde de soufre, etc.) ou les ions de métaux lourds dans l'eau, les polluants organiques, etc.
6 Utilisations du graphite
Dans les crayons
Le graphite est un composant clé de la mine de crayon. Grâce à sa texture douce et à sa structure en couches unique, il peut laisser des marques claires sur le papier après avoir été mélangé à de l'argile et ajusté sa dureté pour répondre aux besoins de l'écriture et de la peinture. De l'apprentissage des élèves à la création artistique, elle est largement utilisée dans toutes sortes d'outils d'écriture. Elle permet aux gens d'exprimer librement leurs idées et leur créativité.
Comme lubrifiant
Le graphite, en tant que lubrifiant, possède un bon pouvoir lubrifiant en raison de la faible force de van der Waals dans la couche intermédiaire et la couche intermédiaire de la structure en couches. Il est largement utilisé dans le domaine mécanique. Qu'il s'agisse des pièces mobiles internes du moteur automobile ou des pièces de transmission mécanique industrielle. Ou même les pièces aérospatiales à haute température et à haute pression, la poudre de graphite peut réduire efficacement la friction et l'usure. Elle assure également un fonctionnement régulier et efficace de l'équipement et prolonge sa durée de vie.
Fabrication de l'acier
Le graphite joue un rôle important dans la fabrication de l'acier. En tant que électrodeIl peut introduire du courant pour produire une fusion par effet Joule des matières premières en ferraille d'acier. En tant que carburateur, la teneur en carbone de l'acier fondu peut être ajustée avec précision. Grâce à sa résistance aux températures élevées et à sa résistance à la corrosion, le revêtement de four protège le corps du four d'aciérie contre les dommages causés par l'acier fondu à haute température et le laitier. En outre, le graphite possède une certaine capacité thermique spécifique. Il peut absorber et libérer de la chaleur au cours du processus de fabrication de l'acier, contribuant ainsi à réguler les fluctuations de température dans le four. Il contribue efficacement au développement efficace, sûr et stable du processus de fabrication de l'acier.
Batterie
Le graphite joue un rôle important dans les batteries et est couramment utilisé comme matériau d'électrode négative dans les batteries lithium-ion. piles. Sa structure en couches offre un espace pour l'insertion et la désinsertion des ions lithium, l'insertion de la charge, la décharge de la décharge, avec une bonne propriété conductrice. Cela garantit le cycle de charge et de décharge de la batterie. Dans le cadre de la recherche sur les nouvelles technologies de batteries, il est également considéré comme le matériau de base. Il joue un rôle dans la promotion du développement de nouveaux systèmes de stockage de l'énergie.
Matériaux réfractaires
Le graphite a un point de fusion élevé et une grande stabilité à la température ; c'est un matériau réfractaire de haute qualité. Dans la métallurgie, la céramique, le verre et d'autres processus industriels à haute température, le graphite est utilisé pour la fabrication de briques réfractaires, de revêtements de surface et d'autres matériaux réfractaires. creusets etc. Il peut résister à l'érosion des métaux fondus et des scories dans un environnement à haute température et maintenir la stabilité structurelle. Il réduit les pertes de chaleur et les risques d'accident et constitue une ligne de sécurité solide pour la production industrielle à haute température.
Réacteurs nucléaires
Le graphite sert de modérateur de neutrons dans les réacteurs nucléaires. En entrant en collision avec les neutrons, les neutrons rapides sont ralentis en neutrons thermiques. Ils contrôlent ainsi le taux de réaction de fission nucléaire et assurent le fonctionnement stable du réacteur. Les premiers réacteurs nucléaires ont de nombreuses utilisations. Mais le graphite se modifie sous l'effet des températures élevées et de l'irradiation neutronique, ce qui nécessite des réponses techniques spéciales pour garantir une utilisation sûre à long terme.
Conclusion
En tant qu'allotrope du carbone, le graphite possède diverses propriétés et est largement utilisé. Ses diverses caractéristiques sont liées les unes aux autres, ce qui détermine ses performances dans différents scénarios. Des crayons de tous les jours à la sidérurgie industrielle, de la fabrication de batteries aux réacteurs nucléaires de haute technologie, le graphite est indispensable. Avec le développement de la science et de la technologie, le graphite a un grand potentiel dans les domaines émergents. Il occupera une position plus critique dans la science des matériaux, la stratégie des ressources mondiales et la stratégie de développement durable. Il continuera à promouvoir le progrès de la société humaine.