En el sistema de los elementos, el átomo de carbono ocupa una posición única e importante, que es la piedra angular de la vida. Y no sólo sustenta todas las formas de vida en la Tierra, sino que también impulsa la innovación en la ciencia de los materiales. Profundizar en la estructura del átomo de carbono puede proporcionar una visión de la lógica interna del origen de la vida y la innovación material.
Información básica sobre el carbono
Número atómico, símbolo químico y masa atómica del carbono
El número atómico del carbono es 6 y su símbolo químico es C. Como el carbono se presenta en la naturaleza en forma de muchos isótopos, su masa atómica relativa se calcula como una media basada en la abundancia relativa de cada isótopo, que es aproximadamente 12,01.
Isótopos del carbono
En la naturaleza, el carbono se presenta en tres isótopos principales: carbono-12, carbono-13 y carbono-14. El carbono-12 es el más común, representando aproximadamente el 98,93% de todo el carbono, cuyo núcleo contiene seis protones y seis neutrones. Esto lo convierte en un estándar para definir las unidades de masa atómica. El carbono-13 constituye aproximadamente 1,07% del núcleo atómico y tiene seis protones y siete neutrones. Se suele utilizar en espectroscopia de resonancia magnética nuclear (RMN) para ayudar a los científicos a estudiar la estructura molecular. El carbono-14 es un isótopo radiactivo con un núcleo formado por seis protones y ocho neutrones. Tiene una vida media de unos 5.730 años y desempeña un papel clave en arqueología. Los arqueólogos pueden datar artefactos midiendo la cantidad de carbono-14 que se desintegra en ellos.
Análisis de la estructura del átomo de carbono
Modelos atómicos y desarrollo teórico
Desde el modelo de esfera sólida de Dalton, pasando por el modelo de pudín de ciruela de Thomson, hasta el modelo nuclear de Rutherford. Así como el modelo de órbita estratificada del electrón de Bohr y los modernos modelos de mecánica cuántica, se ha profundizado en la comprensión humana de la estructura atómica. Estos avances teóricos sentaron las bases para desvelar la estructura de los átomos de carbono. Y los modelos mecánicos cuánticos modernos sugieren que los electrones no se mueven en órbitas fijas, sino que se distribuyen alrededor del núcleo en una nube de probabilidad.
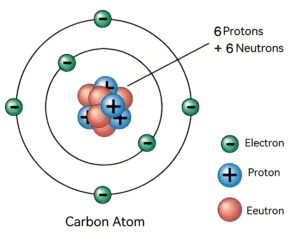
Detalles de la estructura atómica del carbono
Núcleo atómico
El núcleo de un átomo de carbono está compuesto por protones y neutrones, los protones tienen carga positiva y los neutrones son eléctricamente neutros. Debido a la presencia de protones, el núcleo en su conjunto está cargado positivamente. Y como el número de cargas positivas es igual al número de cargas negativas que llevan los electrones fuera del núcleo, todo el átomo es eléctricamente neutro.
Electrones extraños
Los átomos de carbono tienen seis electrones extranucleares, que se distribuyen en diferentes capas de electrones según sus niveles de energía. La primera capa (capa K) contiene hasta dos electrones. La segunda capa (capa L) contiene hasta ocho electrones, y la disposición de los electrones de los átomos de carbono es 2,4. Es decir, la capa K tiene dos electrones y la capa L tiene cuatro electrones. Estos cuatro electrones de valencia confieren al átomo de carbono sus propiedades químicas únicas, permitiéndole formar compuestos estables con otros átomos.
Diversas estructuras del carbono
Alótropos del carbono
Diamante
Es un cristal duro, los átomos de carbono a través de enlaces covalentes para construir una estructura tetraédrica tridimensional, cada átomo de carbono conecta 4 átomos adyacentes. Esto confiere al diamante una dureza y un punto de fusión ultra elevados, lo que lo convierte en el material preferido para cortar, esmerilar y otras industrias. Además, su brillante lustre lo convierte en una gema preciosa.
Grafito
Tiene una estructura en capas y los átomos de carbono de la capa para formar una red hexagonal de enlaces covalentes. La combinación de fuerzas de Van der Waals débiles entre las capas hace que el grafito tenga buena conductividad eléctrica y lubricidad. Y a menudo se puede utilizar grafito en la fabricación de electrodos, lubricantes y minas para lápices.
Fullerenos y nanotubos de carbono
Fullerenos son moléculas en forma de jaula compuestas por átomos de carbono, y la más famosa es el C60, que tiene forma de balón de fútbol. Los nanotubos de carbono están formados por átomos de carbono en una estructura tubular con excelentes propiedades mecánicas, eléctricas y de conductividad térmica. Se pueden utilizar para fabricar materiales compuestos y dispositivos electrónicos de alto rendimiento.
Estructuras moleculares del carbono
Estructura molecular del dióxido de carbono
La molécula de CO2 está formada por 1 átomo de carbono y 2 átomos de oxígeno, los átomos de carbono y los átomos de oxígeno están unidos por dobles enlaces, en línea recta. Esta estructura hace que el dióxido de carbono sea gaseoso a temperatura y presión ambiente. Es una parte importante del ciclo del carbono en la Tierra y el principal gas de efecto invernadero responsable del calentamiento global.
Compuestos orgánicos
Los compuestos orgánicos son compuestos que contienen carbono, pero no incluyen el monóxido de carbono, el dióxido de carbono ni los carbonatos. Las propiedades cuadruvalentes de los átomos de carbono le permiten formar una gran variedad de compuestos orgánicos con hidrógeno, oxígeno, nitrógeno y otros átomos. Constituyen la base de materiales vivos como las proteínas y los ácidos nucleicos.
Conceptos especiales sobre estructuras de carbono
Átomos de carbono terciario
Los átomos de carbono terciarios conectan tres átomos de carbono y tienen una actividad reactiva especial en química orgánica. En la reacción de sustitución nucleofílica de hidrocarburos halogenados, los hidrocarburos halogenados que contienen átomos de carbono terciarios siguen mayoritariamente el mecanismo SN1. Esta propiedad es diferente de la de los hidrocarburos halogenados primarios y secundarios, que se utiliza ampliamente en síntesis orgánica.
Estructura atómica de las fibras de carbono
Fibra de carbono se compone de microcristales de grafito, los átomos están dispuestos a lo largo del eje axial de la fibra. Por eso tiene ventajas de alta resistencia y baja densidad. Con estas propiedades, se puede utilizar ampliamente en la industria aeroespacial, la fabricación de equipos deportivos y otros campos.
Descubrimiento y aplicaciones del carbono
Quién descubrió el carbono
El carbono es uno de los primeros elementos descubiertos y utilizados por el ser humano. Ya en la prehistoria, los humanos utilizaban el carbón vegetal como combustible. Sin embargo, no fue hasta el siglo XVIII cuando el químico francés Lavoisier demostró experimentalmente que el carbono era un elemento. Y basándose en el latín "carbo", le dio el nombre de "carbon", que significa carbón vegetal.
Diez usos del carbono
Combustible
Cuando se queman, los combustibles basados en el carbono, como la madera y el carbón, reaccionan con el oxígeno. Entonces puede liberar calor para calentar, cocinar y generar electricidad.
Producción de acero
Una cantidad adecuada de carbono puede mejorar la resistencia y la dureza del acero. Regulando el contenido de carbono, se pueden producir diferentes propiedades del acero, y utilizarlo para la construcción y la fabricación de maquinaria.
Electrodo de grafito
Electrodo de grafito tiene buena conductividad eléctrica y resistencia a altas temperaturas. Se puede utilizar en los enlaces conductores de la siderurgia de horno eléctrico, aluminio electrolítico y otras industrias.
Mina de lápiz
La mina de los lápices está hecha de grafito mezclado con arcilla, y la estructura en capas del grafito le permite dejar marcas en el papel al escribir.
Adsorción de carbón activado
El carbón activado tiene poros ricos, gran superficie específica, que puede absorber impurezas y sustancias nocivas. Y se puede utilizar en la purificación del agua y el aire y otros escenarios.
Joyas con diamantes
El diamante es un alótropo del carbono, de brillo intenso y gran dureza, que a menudo se utiliza en joyería.
Material de fibra de carbono
Tiene alta resistencia y baja densidad, y se utiliza en la fabricación de equipos aeroespaciales y deportivos para reducir el peso y mejorar el rendimiento.
Mejora del caucho
Añadir negro de humo al caucho puede mejorar su resistencia, resistencia al desgaste y resistencia al envejecimiento, que se utiliza sobre todo en la fabricación de neumáticos.
Conservación de alimentos
El carbón activado puede absorber olores y gases nocivos en los envases de alimentos y prolongar su vida útil.
Productos electrónicos
También se puede utilizar ampliamente el carbono en productos electrónicos, como el grafeno. Tiene excelentes propiedades eléctricas y se espera que se utilice en futuros dispositivos electrónicos.
Conclusión
El átomo de carbono tiene una estructura única, una naturaleza rica y una amplia aplicación. Se ha encontrado desde los materiales básicos de la vida hasta materiales científicos y tecnológicos de vanguardia. El estudio en profundidad de la estructura de los átomos de carbono ha promovido el desarrollo de la sociedad humana y ha contribuido a crear un futuro mejor.