Grafit, karbonun önemli bir allotropu olarak birçok alanda önemli bir rol oynamaktadır. Yapısının derinlemesine araştırılması, grafitin geniş uygulama potansiyelini ortaya çıkarmanın ve yeni malzemelerin geliştirilmesinin anahtarıdır.
İçindekiler
Geçiş
Grafit nedir?
Karbon atomlarından oluşan bir mineral olan grafit, doğada yaygın olarak bulunur. Metalik bir parlaklığa ve yumuşak ve pürüzsüz bir hisse sahiptir. Bu da onu kurşun kalem uçları için ideal bir malzeme yapar. Grafitin rengi çoğunlukla siyah veya koyu gridir. Saflığı ve kristalleşme derecesi ise oluşum ortamına göre değişir.
Grafitin atomik ve moleküler yapısı
Grafitin atomik yapısı
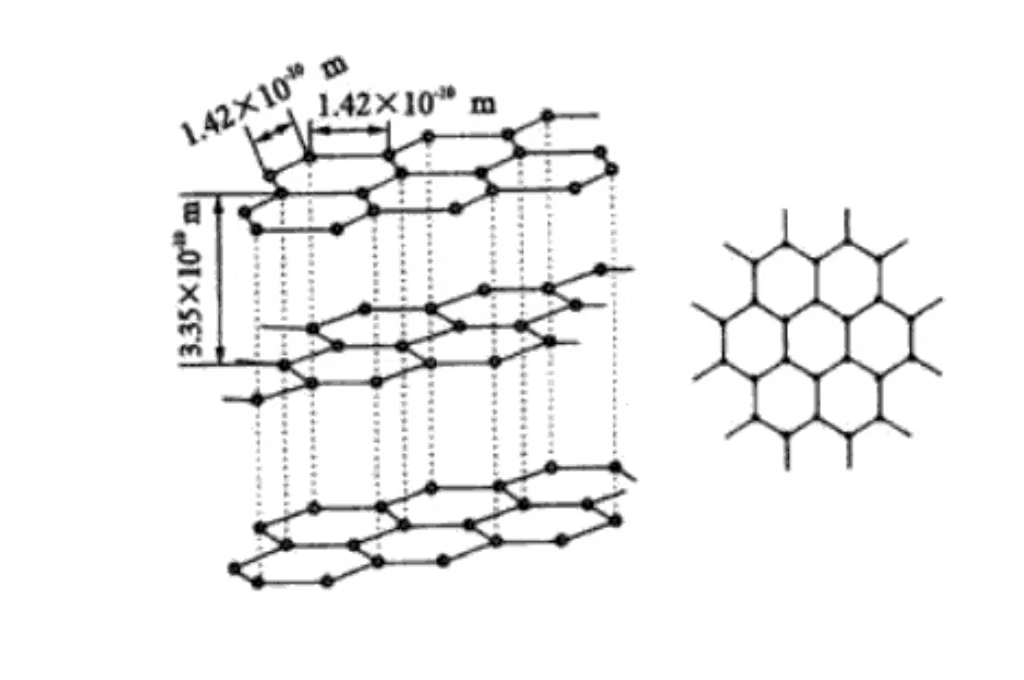
Grafitin temel bileşimi karbondur. Grafitteki karbon atomları kovalent bağlarla birbirine bağlıdır. Her bir karbon atomu ve çevresindeki üç karbon atomu, katı bir atomik iskelet oluşturmak için düzlemde sonsuza kadar uzanan kararlı bir altıgen halka yapısı oluşturur.
Grafitin moleküler yapısı
Moleküler düzeyde grafit şunlardan oluşur katmanlar üst üste yığılmış karbon atomlarından oluşur. Katmanlar arası karbon atomları nispeten zayıf van der Waals kuvvetleri tarafından korunur. Ve bu katmanlı yapı grafitin neden mükemmel kayganlık ve katmanlar arasında kolay kayma özelliğine sahip olduğunu açıklar.
Grafit yapısının iki temel unsuru
Grafit altıgen kristal yapı
Düzenlemeler
Grafit altıgen bir kristal yapıya sahiptir, karbon atomları 120 derecelik bir Açı da dahil olmak üzere düzlemde altıgenler halinde yakından düzenlenmiştir. Düzenleme düzenli ve kararlıdır, elektron iletimine elverişlidir, iyi elektrik iletkenliğinin temelidir.
Katmanlama
Karbon atomları paralel düzlemlerde istiflenir, katman aralığı yaklaşık 0,335 nm'dir. Katmanlar arasındaki van der Waals kuvveti zayıftır, bu da grafitin dış katmanlar arasında kaymasını kolaylaştırır ve yağlanabilirliğe sahiptir. Bu, mekanik imalat alanında yaygın olarak bir yağlayıcı olarak kullanılır.
Kristal yapı katmanları
Her bir karbon atomu katmanı kovalent bağlar aracılığıyla bir ağ düzlemi oluşturur. Bu, uzayda düzenli bir şekilde düzenlenerek grafitin makroskopik kristal özelliklerini ve anizotropisini verir. Katmandaki güçlü kovalent bağ, grafitin düzlemde yüksek mukavemet ve sertliğe sahip olmasını sağlar. Dikey düzlem yönü, zayıf katmanlar arası kuvvet nedeniyle düşük mukavemete sahiptir.
Karbon atomları içindeki bağlar
Van der Waal Kuvvetleri
Katmanlar arası karbon atomları, zayıf olan van der Waals kuvvetine dayanır, bu da grafit katmanları arasında kolay kayma ayrımı ve kayganlık sağlar. Ancak aynı zamanda grafitin ara katman yapısını belirli koşullar altında (yüksek sıcaklık ve basınç gibi) değişken hale getirir. Elmas yapısına dönüştürülebilmesi gibi.
Katman ayırma
Zayıf van der Waals kuvveti nedeniyle grafit tabakası küçük bir kesme kuvveti uygulanarak ayrılabilir. Bu sadece kayganlığı yansıtmakla kalmaz, aynı zamanda özel kompozit malzemeler hazırlamak için grafitin fiziksel ve kimyasal özelliklerinin değiştirilebileceği interkalasyon reaksiyonları olasılığını da yaratır. Lityum-iyon piller için negatif elektrot malzemeleri gibi.
Kovalent bağlar
Katmandaki karbon atomları, kararlı bir altıgen yapı oluşturmak için kovalent bağlarla sıkıca bağlanır. Bu, grafitin düzlemdeki yüksek sertliğini ve mukavemetini belirler, elektrot malzemelerinin uygulanmasında yapısal kararlılığını garanti eder. Ve elektronların hareketini sınırlayarak düzlemdeki anizotropiyi etkiler.
Sp2 hibridizasyonu
Bağ Açısı
Karbon atomları sp2 hibridizasyonunu benimser, bir 2s ve iki 2p orbitali hibridize olarak üç eşdeğer sp2 hibridizasyon orbitali oluşturur. Bunlar yaklaşık 120 derecelik bir açı ile bir düzlem üçgen içinde dağıtılır. Böylece karbon atomları, elektron delokalizasyon iletimine ve iyi elektrik iletkenliğine elverişli olan altıgen bir yapı oluşturmak için üç bitişik karbon atomuyla kararlı kovalent bağlar oluşturur.
Karbon atomları
Karbon atomu, sp2 hibrit orbitalleri aracılığıyla çevresindeki üç karbon atomu ile düzlemsel bir iskelet oluşturur. Hibrit olmayan 2p orbitallerinin dikey düzlemleri ise üst üste binerek delokalize π-elektron bulutları oluşturur. π-elektron bulutları grafite iyi bir elektrik iletkenliği kazandırır ve elektronlar elektrik alanlarındaki değişikliklere yanıt olarak serbestçe hareket edebilir. Grafiti kimyasal reaksiyonlarda aktif hale getirir ve elektrokimyasal süreçlere katılır. Lityum-iyon pillerde elektron transfer ortamı gibi.
Anizotropi
Düzlem içi nitelikler ve düzlem dışı nitelikler
Grafit farklı yönlerde önemli anizotropi gösterir. Düzlemde, kovalent bağ güçlüdür, yüksek sertlik, mukavemet ve iyi elektrik iletkenliği vardır. Grafit fiber takviyeli kompozit malzemeleri, düzlem içi gerilme mukavemetini kullanmak için bir takviye fazı olarak kullanabileceğiniz gibi. Dikey düzlem yönünde, zayıf katmanlar arası van der Waals kuvveti, düşük mukavemet ve zayıf iletkenlik nedeniyle. Bu özellik, farklı uygulama senaryolarında hedeflenen bir avantaj sağlar.
Atom Enerjisi düzenlemeleri
Grafit karbon atomları, düzlemde altıgenler ve uzayda istifleme katmanları oluşturarak belirli bir yasaya göre düzenlenir. Bu düzenleme kristal yapıyı ve fiziksel ve kimyasal özellikleri belirler. X-ışını kırınımı, kristalliği ve yapısal parametreleri, düzenli düzenlemesinin sunduğu özel desene göre belirleyebilir. Atomik düzenlemenin kararlılığı, grafitin belirli bir sıcaklık ve basınç aralığında istikrarlı performans göstermesini sağlar. Yüksek sıcaklıkta refrakter bir malzeme olarak grafit gibi, yapının bütünlüğünü sağlayabilir ve endüstriyel uygulamaların güvenilirliği için koruma sağlayabilir.
Grafitin kafes ve kristal yapısı
Grafitin kafes yapısı
Grafit altıgen kafes yapısına sahiptir, a ekseni ve b ekseni eşit uzunluktadır. Açı 120 derecedir, c ekseni karbon atomu düzlemine diktir. Uzunluğu, katmanlı yapının periyodik düzenlemesini yansıtır, belirli simetri ve kristalografik özelliklere sahip altıgen kristal sistemine aittir.
Grafit kristal yapısı
Grafit kristali, uzayda düzenli bir şekilde düzenlenmiş çok sayıda altıgen kafes biriminden oluşur. Ve iç karbon atomları oldukça düzenli bir şekilde düzenlenmiştir. Kusurlar ve safsızlıklar, elektron ve fonon taşınımını, kimyasal reaksiyonları ve malzeme homojenliğini etkileyerek performansını önemli ölçüde değiştirecektir.
Grafit yapısındaki üç yaygın kusur
Grafit yapısındaki kusurların performansı üzerinde büyük etkisi vardır.
Boşluk ve boşluk atomları gibi noktasal kusurlar, atomik bütünlüğü bozacak ve elektron iletimini ve mekanik özellikleri etkileyecektir.
Dislokasyon gibi doğrusal kusurlar plastik deformasyonu ve mukavemeti etkiler.
Tane sınırı gibi yüzey kusurları, elektronların ve fononların iletimini engeller, iletkenliği ve termal iletkenliği azaltır. Ve kolayca kimyasal reaksiyonlara ve safsızlık toplanmasına yol açar.
Grafit yapısı ile ilgili kavramlar
Grafit Lewis yapısı
Grafitin Lewis yapısı, karbon atomları arasındaki elektron paylaşımını gösterir ve komşu karbon atomlarıyla kovalent bağlar oluşturarak sekiz elektronlu kararlı yapıyı karşılar. Müdahil olmayan elektronlar delokalize π elektron bulutları oluşturur. Bu, kimyasal bağları ve elektron dağılımını anlamak için temel sağlar.
Grafit hibridizasyonu
Grafit karbon atomlarının sp2 hibridizasyonu, eşsiz yapısının ve özelliklerinin temelini oluşturur. Bu, grafite çeşitli mükemmel özellikler kazandıran düzlemsel bir yapı, delokalize π-elektron bulutu ile sonuçlanır.
Grafit sembolleri ve formülleri
Grafitin kimyasal sembolü "C "dir. Makromoleküler yapıyı basit bir moleküler formülle ifade etmek zor olsa da, kimyasal hesaplama ve reaksiyon formülünde. "C", karbonun dönüşümünü ve korunumunu yansıtarak grafitin reaksiyonunu temsil edebilir.
Grafit yapısı ve bağlanma
Grafitin katmanlı yapısı ve yüzey özellikleri, bağlanma özellikleri açısından büyük önem taşımaktadır. Katmanlar arası van der Waals kuvveti zayıftır, bu nedenle etkileşimi artırmak için grafit yüzeyini modifiye etmek veya uygun bir bağlayıcı seçmek gerekir. Yüzey modifikasyonu, fonksiyonel gruplar veya kabalaştırma işlemi getirebilir. Ve bağlayıcının polar grupları grafit yüzeyindeki karbon atomlarıyla güçlü bir şekilde bağlanabilir. Kompozit malzemelerde, iyi bağlanma performansı, genel mekanik ve işlevsel özellikleri garanti etmenin anahtarıdır. Ve zayıf bağlanma, arayüzey gerilim yoğunlaşmasına neden olarak malzeme arızasına yol açabilir.
Grafitin Yapısını ve Diğer Malzemelerden Farkını Açıklayın
Grafit Yapı vs Grafen Yapı
Aslında, grafen bir atom kalınlığında grafit tabakasını temsil eder. Her 1 mm kalınlığındaki grafit tabakasında üst üste dizilmiş yaklaşık 3 milyon grafen katmanı vardır. Grafen, grafitin bir katmanı olarak kabul edilebilirken, grafit üst üste birkaç grafen katmanından oluşur.
Grafit ve elmas yapısının karşılaştırılması
Yapısal farklılıklar
Elmasın karbon atomları tetrahedral uzay yapısı oluşturmak için sp3 hibridizasyonunu benimser ve atomlar arasındaki kovalent bağlar çok güçlüdür. Grafit sp2 hibrit düzlemsel altıgen ve katmanlıdır, katmanlar arasında zayıf van der Waals kuvvetleri vardır.
Performans farklılıkları
Yapısal farklılıklar belirgin performans farklılıklarına neden olur. Elmas sertliği çok yüksektir, talaşlı imalatta kullanılır; Grafit yumuşak doku, iyi kayganlık, yağlayıcı ve kurşun kalem ucu olarak kullanılır. Grafit elektriği iletir, elmas zor iletir. Elmas yüksek kırılma indisine ve şeffaflığa sahiptir, mücevheratta kullanılır; Grafit siyah ve opaktır.
Grafit yapı türleri
Doğal Grafit
Tipik olarak grafit şist, grafit gnays, grafit taşıyan şist ve metamorfik şeylde görülür. Kristal formuna göre, doğal grafit aynı anda iki çeşide ayrılabilir: kristal grafit - ki bu da pul grafit ve toprak grafit olarak da bilinen kriptokristal grafit olarak ikiye ayrılır.
Sentetik Grafit
Sentetik grafit bir tür kimyasal üründür. Ana bileşeni karbondur. Organik polimerlerin yüksek sıcaklıkta pirolizi ve grafitleştirilmesi yoluyla elde edilir.
Genişletilebilir grafit ve nanografit yapılar gibi özel grafit yapılar. Özel işlemle genişletilebilir grafit, ara katman ekleme malzemesi, yüksek sıcaklıkta ayrışma ve genişleme, iyi alev geciktirici ile yanmaz malzemeler için kullanılır. Nano-grafit levhalar ve nano-grafit lifler gibi nano-grafit yapılar, geniş spesifik yüzey alanına, yüksek yüzey aktivitesine ve mükemmel mekanik özelliklere sahiptir. Enerji depolama, katalizör taşıyıcıları ve yüksek performanslı kompozit malzemeler alanlarında büyük bir potansiyele sahiptir.
Grafit yapısı ve kullanımı arasındaki korelasyon
Grafitin benzersiz yapısı geniş kullanım alanını belirler. İyi elektrik iletkenliği onu pillerde ve elektrolitik hücrelerde kullanılan bir elektrot malzemesi yapar. Yüksek sıcaklık kararlılığı ve kimyasal inertliği onu çelik endüstrisi için bir refrakter yapar. Yağlayıcılık özelliği, makine imalatında yağlayıcı olarak kullanılmasını sağlar. Havacılık ve uzay alanında grafit kompozitler, düşük yoğunlukları, yüksek mukavemetleri ve termal kararlılıkları nedeniyle uçak ve roket bileşenlerinin üretiminde kullanılır. Ayrıca grafit, kurşun kalem üretiminde, grafen hazırlanmasında ve diğer alanlarda da önemli bir rol oynamaktadır. Ve her uygulama grafit yapısıyla yakından bağlantılıdır.
Sonuç
Grafitin yapısı, performansı ve uygulamayı derinden etkileyen benzersizliğini ve karmaşıklığını çok boyutlu olarak gösterir. Grafit yapısının derinlemesine araştırılması ve anlaşılması, malzeme bilimi ve enerji gibi birçok alanda yenilikçi uygulaması için geniş umutlar açmaktadır. Bu da modern toplumdaki malzeme ve enerji sorunlarının üstesinden gelinmesine yardımcı olmaktadır.