In het systeem van elementen neemt het koolstofatoom een unieke en belangrijke positie in, het is de hoeksteen van het leven. En het ligt niet alleen ten grondslag aan alle vormen van leven op aarde, maar is ook de drijvende kracht achter innovatie in de materiaalkunde. Door dieper in te gaan op de structuur van het koolstofatoom kan inzicht worden verkregen in de interne logica van de oorsprong van het leven en materiaalinnovatie.
Basisinformatie over koolstof
Atoomnummer, chemisch symbool en atoommassa van koolstof
Het atoomnummer van koolstof is 6 en het chemische symbool is C. Omdat koolstof in de natuur voorkomt in de vorm van vele isotopen, wordt de relatieve atoommassa berekend als een gemiddelde op basis van de relatieve overvloed van elke isotoop, die ongeveer 12,01 is.
Isotopen van koolstof
In de natuur komen drie isotopen van koolstof voor: koolstof-12, koolstof-13 en koolstof-14. Koolstof-12 komt het meest voor, ongeveer 98,93% van alle koolstof. Koolstof-12 is de meest voorkomende, goed voor ongeveer 98,93% van alle koolstof, waarvan de kern zes protonen en zes neutronen bevat. Hierdoor is het een standaard voor het definiëren van atomaire massa eenheden. Koolstof-13 maakt ongeveer 1,07% van de atoomkern uit en heeft zes protonen en zeven neutronen. Je kunt het vaak gebruiken in nucleaire magnetische resonantie (NMR) spectroscopie om wetenschappers te helpen bij het bestuderen van de moleculaire structuur. Koolstof-14 is een radioactieve isotoop met een kern bestaande uit zes protonen en acht neutronen. Het heeft een halveringstijd van ongeveer 5.730 jaar en speelt een belangrijke rol in de archeologie. Archeologen kunnen artefacten dateren door te meten hoeveel koolstof-14 erin vervalt.
Analyse van de structuur van koolstofatomen
Atoommodellen en theoretische ontwikkeling
Van het solide bolmodel van Dalton tot het plumpuddingmodel van Thomson en het nucleaire model van Rutherford. Net als Bohr's gelaagde baanmodel voor elektronen en moderne kwantummechanische modellen, is het begrip van de menselijke atoomstructuur verdiept. Deze theoretische ontwikkelingen legden de basis voor het onthullen van de structuur van koolstofatomen. En moderne kwantummechanische modellen suggereren dat elektronen niet in vaste banen bewegen, maar in een wolk van waarschijnlijkheid rond de kern zijn verdeeld.
Details van de atoomstructuur van koolstof
Atoomkern
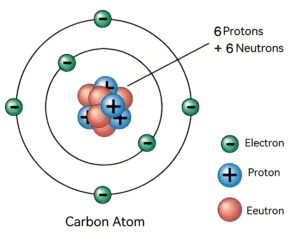
De kern van een koolstofatoom bestaat uit protonen en neutronen, protonen hebben een positieve lading en neutronen zijn elektrisch neutraal. Door de aanwezigheid van protonen is de kern als geheel positief geladen. En omdat het aantal positieve ladingen gelijk is aan het aantal negatieve ladingen van de elektronen buiten de kern, is het hele atoom elektrisch neutraal.
Elektronen van buitenaf
Koolstofatomen hebben zes extranucleaire elektronen, die verdeeld zijn over verschillende elektronenlagen op basis van hun energieniveaus. De eerste laag (K-laag) bevat maximaal twee elektronen. De tweede laag (L-laag) bevat maximaal acht elektronen en de elektronenindeling van koolstofatomen is 2,4. Dat wil zeggen, de K-laag heeft twee elektronen. Dat wil zeggen, de K-laag heeft twee elektronen en de L-laag heeft vier elektronen. Deze vier valentie-elektronen geven het koolstofatoom zijn unieke chemische eigenschappen, waardoor het stabiele verbindingen kan vormen met andere atomen.
Diverse structuren van koolstof
Allotropen van koolstof
Diamant
Het is een hard kristal, koolstofatomen bouwen via covalente bindingen een driedimensionale tetraëderstructuur, waarbij elk koolstofatoom 4 aangrenzende atomen verbindt. Dit geeft diamant een ultrahoge hardheid en smeltpunt, waardoor het het materiaal bij uitstek is voor snijden, slijpen en andere industrieën. Bovendien maakt de heldere glans diamant ook tot een kostbare edelsteen.
Grafiet
Het heeft een gelaagde structuur en de koolstofatomen in de laag vormen een hexagonaal netwerk van covalente bindingen. Door de combinatie van zwakke van der Waals krachten tussen de lagen heeft grafiet een goede elektrische geleidbaarheid en smeerbaarheid. En je kunt vaak grafiet bij de productie van elektroden, smeermiddelen en potloodstiften.
Fullerenen en koolstofnanobuizen
Fullerenen zijn kooimoleculen die bestaan uit koolstofatomen en de bekendste is C60, dat de vorm van een voetbal heeft. Koolstofnanobuizen bestaan uit koolstofatomen in een buisvormige structuur met uitstekende mechanische, elektrische en thermische geleidbaarheidseigenschappen. Je kunt er hoogwaardige composietmaterialen en elektronische apparaten van maken.
Moleculaire structuren van koolstof
Moleculaire structuur van kooldioxide
CO2-molecuul bestaat uit 1 koolstofatoom en 2 zuurstofatomen, koolstofatomen en zuurstofatomen zijn verbonden door dubbele bindingen, in een rechte lijn. Door deze structuur is kooldioxide gasvormig bij kamertemperatuur en -druk. Het is een belangrijk onderdeel van de koolstofcyclus op aarde en het belangrijkste broeikasgas dat verantwoordelijk is voor de opwarming van de aarde.
Organische verbindingen
Organische verbindingen zijn verbindingen die koolstof bevatten, maar geen koolmonoxide, kooldioxide en carbonaten. De vierwaardige eigenschappen van koolstofatomen zorgen ervoor dat ze een verscheidenheid aan organische verbindingen kunnen vormen met waterstof, zuurstof, stikstof en andere atomen. Ze vormen de basis van levensstoffen zoals eiwitten en nucleïnezuren.
Speciale concepten in koolstofstructuren
Tertiaire koolstofatomen
Tertiaire koolstofatomen verbinden drie koolstofatomen en hebben een speciale reactieve activiteit in de organische chemie. In de nucleofiele substitutiereactie van gehalogeneerde koolwaterstoffen volgen gehalogeneerde koolwaterstoffen met tertiaire koolstofatomen meestal het SN1-mechanisme. Deze eigenschap verschilt van primaire en secundaire gehalogeneerde koolwaterstoffen, die veel worden gebruikt in organische synthese.
Atomaire structuur van koolstofvezels
Koolstofvezel is samengesteld uit grafietmicrokristallen, atomen zijn gerangschikt langs de axiale as van de vezel. De vezel heeft dus een hoge sterkte en een lage dichtheid. Met deze eigenschappen kun je het op grote schaal gebruiken in de ruimtevaart, sportartikelenproductie en andere gebieden.
Ontdekking en toepassingen van koolstof
Wie ontdekte koolstof
Koolstof is een van de eerste elementen die de mens ontdekte en gebruikte. Al in de prehistorie gebruikten mensen houtskool als brandstof. Het duurde echter tot de 18e eeuw voordat de Franse scheikundige Lavoisier experimenteel bewees dat koolstof een element was. En op basis van het Latijnse "carbo" gaf hij het de naam "koolstof", wat houtskool betekent.
Tien toepassingen van koolstof
Brandstof
Bij verbranding reageren koolstofhoudende brandstoffen zoals hout en kolen met zuurstof. Vervolgens kan er warmte vrijkomen voor verwarming, koken en energieopwekking.
Staalproductie
De juiste hoeveelheid koolstof kan de sterkte en hardheid van staal verbeteren. Door het koolstofgehalte te regelen, kun je verschillende eigenschappen van staal maken en het gebruiken voor de bouw en machinebouw.
Grafietelektrode
Grafietelektrode heeft een goed elektrisch geleidingsvermogen en een hoge temperatuurbestendigheid. Je kunt het gebruiken in de geleidende verbindingen van elektrische oven staalproductie, elektrolytisch aluminium en andere industrieën.
Potlood
Potloodlood is gemaakt van grafiet vermengd met klei, en de structuur van de grafietlaag zorgt ervoor dat het tijdens het schrijven sporen achterlaat op het papier.
Actieve kooladsorptie
Actieve kool heeft rijke poriën en een groot specifiek oppervlak, waardoor het onzuiverheden en schadelijke stoffen kan absorberen. En je kunt het gebruiken in water- en luchtzuivering en andere scenario's.
Diamanten sieraden
Diamant is een allotroop van koolstof, die een heldere glans en hoge hardheid heeft en vaak in sieraden wordt verwerkt.
Materiaal koolstofvezel
Het heeft een hoge sterkte, lage dichtheid en wordt gebruikt in de ruimtevaart en bij de productie van sportuitrusting om het gewicht te verminderen en de prestaties te verbeteren.
Rubberverbetering
Het toevoegen van carbon black aan rubber kan de sterkte, slijtvastheid en verouderingsbestendigheid verbeteren, wat meestal wordt gebruikt bij de productie van banden.
Voedsel conserveren
Actieve kool kan geuren en schadelijke gassen in voedselverpakkingen absorberen en de houdbaarheid van voedsel verlengen.
Elektronische producten
Je kunt koolstof ook op grote schaal gebruiken in elektronische producten, zoals grafeen. Het heeft uitstekende elektrische eigenschappen en zal naar verwachting worden gebruikt in toekomstige elektronische apparaten.
Conclusie
Het koolstofatoom heeft een unieke structuur, een rijke natuur en een brede toepassing. Van de basismaterialen van het leven tot geavanceerde wetenschappelijke en technologische materialen, het is gevonden. Diepgaand onderzoek naar de structuur van koolstofatomen heeft de ontwikkeling van de menselijke samenleving bevorderd en bijgedragen aan een betere toekomst.