Grafiet, als een belangrijke allotroop van koolstof, speelt een belangrijke rol op vele gebieden. De diepgaande verkenning van de structuur is de sleutel tot het ontsluiten van het brede toepassingspotentieel van grafiet en de ontwikkeling van nieuwe materialen.
Inhoudsopgave
Schakel
Wat is grafiet?
Grafiet, een mineraal gemaakt van koolstofatomen, is wijdverspreid in de natuur. Het heeft een metaalachtige glans en voelt zacht en glad aan. Dit maakt het een ideaal materiaal voor potloodstiften. De kleur van grafiet is meestal zwart of donkergrijs. De zuiverheid en kristallisatiegraad variëren afhankelijk van de omgeving waarin het wordt gevormd.
Atomaire en moleculaire structuur van grafiet
Atoomstructuur van grafiet
De voornaamste samenstelling van grafiet is koolstof. De koolstofatomen in grafiet zijn met elkaar verbonden door covalente bindingen. En elk koolstofatoom en de omliggende drie koolstofatomen vormen een stabiele zeshoekige ringstructuur, die zich oneindig uitstrekt in het vlak om een solide atomair skelet te vormen.
Moleculaire structuur van grafiet
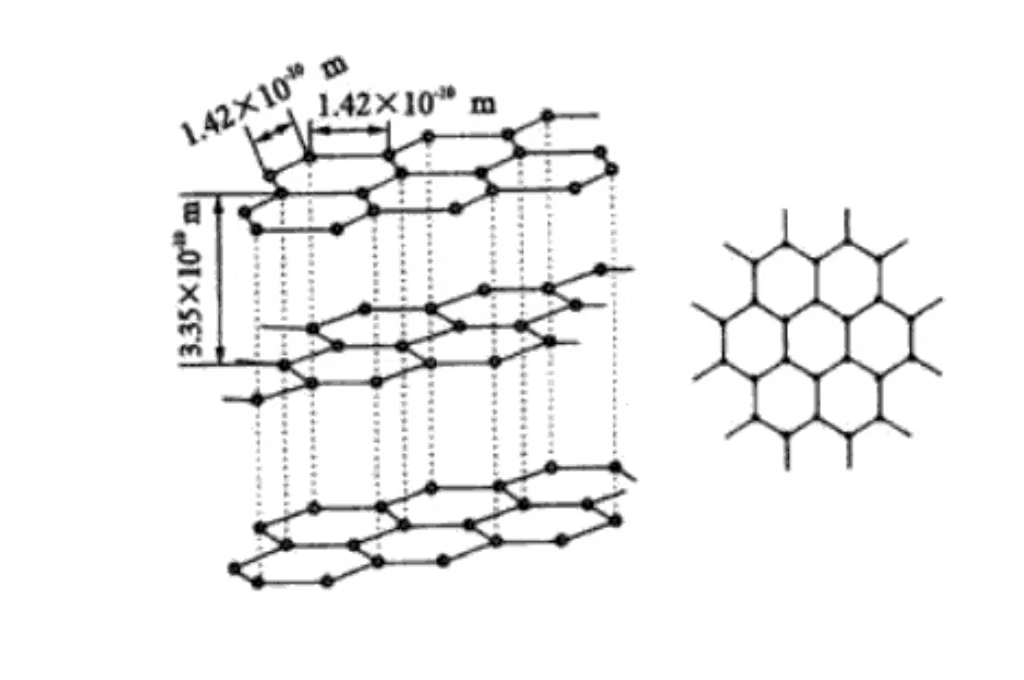
Op moleculair niveau is grafiet opgebouwd uit lagen van koolstofatomen op elkaar gestapeld. De koolstofatomen tussen de lagen worden in stand gehouden door relatief zwakke van der Waals krachten. En deze gelaagde structuur verklaart waarom grafiet uitstekend smeert en gemakkelijk glijdt tussen de lagen.
Twee belangrijke elementen van grafietstructuur
Grafiet hexagonale kristalstructuur
Regelingen
Grafiet heeft een hexagonale kristalstructuur, koolstofatomen zijn nauw gerangschikt in zeshoeken in het vlak, met inbegrip van een hoek van 120 graden. De ordening is regelmatig en stabiel, bevorderlijk voor elektronengeleiding, is de basis van de goede elektrische geleidbaarheid.
Lagen
De koolstofatomen zijn gestapeld in parallelle vlakken, de afstand tussen de lagen is ongeveer 0,335 nm. En de van der Waals kracht tussen de lagen is zwak, waardoor het grafiet gemakkelijk glijdt tussen de externe lagen en smeerbaar is. Dit wordt vaak gebruikt als smeermiddel bij mechanische fabricage.
Lagen van kristalstructuur
Elke laag koolstofatomen vormt een netwerkvlak door middel van covalente bindingen. Dit is op een ordelijke manier gerangschikt in de ruimte, wat de macroscopische kristalkenmerken en anisotropie van grafiet geeft. Door de sterke covalente binding in de laag heeft het grafiet een hoge sterkte en hardheid in het vlak. De verticale vlakke richting heeft een lage sterkte door de zwakke kracht tussen de lagen.
Bindingen binnen koolstofatomen
Van der Waal Krachten
De koolstofatomen tussen de lagen vertrouwen op de van der Waals-kracht, die zwak is, wat resulteert in gemakkelijke glijscheiding tussen grafietlagen en smeerbaarheid. Maar het maakt de tussenlaagstructuur van grafiet ook variabel onder bepaalde omstandigheden (zoals hoge temperatuur en druk). Zo kan het worden omgezet in een diamantstructuur.
Scheiding van lagen
Door de zwakke van der Waals kracht kan de grafietlaag worden gescheiden door een kleine schuifkracht uit te oefenen. Dit weerspiegelt niet alleen de smeerbaarheid, maar creëert ook de mogelijkheid tot intercalatiereacties, waardoor de fysische en chemische eigenschappen van grafiet kunnen worden veranderd om speciale composietmaterialen te maken. Zoals negatieve elektrodematerialen voor lithium-ionbatterijen.
Covalente bindingen
De koolstofatomen in de laag zijn nauw met elkaar verbonden door covalente bindingen om een stabiele hexagonale structuur te vormen. Dit bepaalt de hoge hardheid en sterkte van grafiet in het vlak en garandeert de structurele stabiliteit bij de toepassing van elektrodematerialen. En het beperkt de beweging van elektronen, waardoor de anisotropie in het vlak wordt beïnvloed.
Sp2 hybridisatie
Obligatiehoek
Koolstofatomen nemen sp2 hybridisatie aan, één 2s en twee 2p orbitalen hybridiseren tot drie equivalente sp2 hybridisatie orbitalen. Deze zijn verdeeld in een vlakke driehoek met een hoek van ongeveer 120 graden. Zodat koolstofatomen stabiele covalente bindingen vormen met drie aangrenzende koolstofatomen om een hexagonale structuur op te bouwen, die bevorderlijk is voor elektronendelokalisatiegeleiding en een goed elektrisch geleidingsvermogen.
Koolstofatomen
Het koolstofatoom bouwt een planair skelet met drie omliggende koolstofatomen door middel van sp2 hybride orbitalen. En de verticale vlakken van niet-hybride 2p-orbitalen overlappen elkaar om gedelokaliseerde π-elektronenwolken te vormen. π-elektronenwolken geven grafiet een goede elektrische geleidbaarheid, waarin elektronen vrij kunnen bewegen in reactie op veranderingen in elektrische velden. En maken grafiet actief in chemische reacties en nemen deel aan elektrochemische processen. Zoals een medium voor elektronenoverdracht in lithium-ionbatterijen.
Anisotropie
In-vlak eigenschappen en uit-vlak eigenschappen
Het grafiet vertoont een aanzienlijke anisotropie in verschillende richtingen. In het vlak is de covalente binding sterk, met een hoge hardheid, sterkte en goede elektrische geleiding. Zo kun je grafietvezelversterkte composietmaterialen gebruiken als versterkingsfase om de treksterkte in het vlak te gebruiken. In het verticale vlak richting, als gevolg van de zwakke inter-laag van der Waals kracht, lage sterkte en slechte geleidbaarheid. Deze eigenschap maakt het een gericht voordeel in verschillende toepassingsscenario's.
Regelingen voor atoomenergie
De koolstofatomen van grafiet zijn gerangschikt volgens een specifieke wet, die zeshoeken vormt in het vlak en stapellagen in de ruimte. Deze ordening bepaalt de kristalstructuur en de fysische en chemische eigenschappen. Röntgendiffractie kan de kristalliniteit en structurele parameters bepalen aan de hand van het specifieke patroon van de geordende ordening. En de stabiliteit van de atomaire ordening zorgt ervoor dat grafiet stabiel blijft presteren in een bepaald temperatuur- en drukbereik. Zo kan grafiet als vuurvast materiaal bij hoge temperatuur de integriteit van de structuur waarborgen en bescherming bieden voor de betrouwbaarheid van industriële toepassingen.
Rooster- en kristalstructuur van grafiet
Roosterstructuur van grafiet
Grafiet heeft een hexagonaal rooster, a-as en b-as zijn even lang. En de hoek is 120 graden, c-as staat loodrecht op het koolstofatoom vlak. De lengte weerspiegelt de periodieke ordening van de gelaagde structuur, behoort tot het hexagonale kristalsysteem, met specifieke symmetrie en kristallografische kenmerken.
Grafiet kristalstructuur
Het grafietkristal bestaat uit talloze hexagonale roosterunits die op een geordende manier in de ruimte zijn gerangschikt. En de interne koolstofatomen zijn op een zeer geordende manier gerangschikt. De defecten en onzuiverheden veranderen de prestaties aanzienlijk en beïnvloeden het elektronen- en fonentransport, de chemische reacties en de uniformiteit van het materiaal.
Drie veel voorkomende defecten in grafietstructuur
De defecten in de grafietstructuur hebben een grote invloed op de prestaties.
Puntdefecten, zoals vacature- en spelingatomen, vernietigen de atomaire integriteit en beïnvloeden de elektronengeleiding en mechanische eigenschappen.
Lineaire defecten zoals dislocatie beïnvloeden plastische vervorming en sterkte.
Oppervlaktegebreken, zoals de korrelgrens, belemmeren de transmissie van elektronen en fononen, verminderen de geleidbaarheid en de thermische geleidbaarheid. En het leidt gemakkelijk tot chemische reacties en aggregatie van onzuiverheden.
Grafiet structuur gerelateerde concepten
Grafiet Lewis structuur
De Lewisstructuur van grafiet toont de elektronendeling tussen koolstofatomen en voldoet aan de stabiele structuur met acht elektronen door covalente bindingen te vormen met naburige koolstofatomen. De niet-betrokken elektronen vormen gedelokaliseerde π elektronenwolken. Dit vormt de basis voor het begrijpen van chemische bindingen en elektronenverdeling.
Grafiet hybridisatie
De sp2 hybridisatie van grafiet koolstofatomen ligt aan de basis van zijn unieke structuur en eigenschappen. Dit resulteert in een vlakke structuur en een gedelokaliseerde π-elektronenwolk, waardoor grafiet verschillende uitstekende eigenschappen heeft.
Grafietsymbolen en -formules
Het chemische symbool van grafiet is "C". Hoewel het moeilijk is om de macromoleculaire structuur uit te drukken met een eenvoudige molecuulformule, maar in de chemische berekening en reactieformule. "C" kan de reactie van grafiet weergeven, wat de transformatie en het behoud van koolstof weerspiegelt.
Grafietstructuur en -binding
De gelaagde structuur en oppervlakte-eigenschappen van grafiet zijn van groot belang voor de verbindingseigenschappen. De van der Waals kracht tussen de lagen is zwak, dus is het nodig om het grafietoppervlak aan te passen of een geschikt bindmiddel te kiezen om de interactie te versterken. De oppervlaktemodificatie kan functionele groepen introduceren of een coarseenbehandeling. En de polaire groepen van het bindmiddel kunnen zich sterk binden met de koolstofatomen op het grafietoppervlak. In composietmaterialen is een goede hechting de sleutel om de algemene mechanische en functionele eigenschappen te garanderen. Een slechte hechting kan gemakkelijk interfaciale spanningsconcentratie veroorzaken, wat kan leiden tot materiaalbreuk.
Verklaar de structuur van grafiet en andere materialen Verschil
Grafietstructuur vs. Grafeenstructuur
Eigenlijk, grafeen staat voor een laag grafiet van één atoom dik. In elk 1 mm dik vel grafiet zitten ongeveer 3 miljoen lagen grafeen op elkaar gestapeld. Grafeen kan worden beschouwd als één laag grafiet, terwijl grafiet bestaat uit meerdere lagen grafeen op elkaar.
Vergelijking van grafiet- en diamantstructuur
Structurele verschillen
De koolstofatomen van diamant nemen sp3 hybridisatie aan om een tetrahedrale ruimtestructuur te vormen en de covalente bindingen tussen de atomen zijn zeer sterk. Grafiet is sp2 hybride zeshoekig en gelaagd, met zwakke van der Waals krachten tussen de lagen.
Prestatieverschillen
Structurele verschillen resulteren in duidelijke prestatieverschillen. De hardheid van diamant is zeer hoog en wordt gebruikt bij machinale bewerking; grafiet heeft een zachte textuur, is goed smeerbaar en wordt gebruikt als smeermiddel en potloodstift. Grafiet geleidt elektriciteit, diamant nauwelijks. Diamant heeft een hoge brekingsindex en transparantie, gebruikt in sieraden; grafiet is zwart en ondoorzichtig.
Soorten grafietstructuur
Natuurlijk grafiet
Het komt meestal voor in grafietschist, grafietgneis, grafiethoudende schist en metamorfe schalie. Volgens kristalvorm, natuurlijk grafiet kan tegelijkertijd worden onderverdeeld in twee soorten: kristallijn grafiet, dat verder wordt onderverdeeld in vlokgrafiet en cryptokristallijn grafiet, ook wel bekend als aardgrafiet.
Synthetisch grafiet
Synthetisch grafiet is een soort chemisch product. Het belangrijkste ingrediënt is koolstof. Het wordt verkregen door pyrolyse en grafitisering bij hoge temperatuur van organische polymeren.
Speciale grafietstructuren zoals expandeerbaar grafiet en nanografietstructuren. Uitzetbaar grafiet door speciale behandeling, tussenlaags tussenvoegmateriaal, ontleding en uitbreiding bij hoge temperatuur, met goede vlamvertraging, gebruikt voor vuurvaste materialen. Nano-grafietstructuren, zoals nano-grafietvellen en nano-grafietvezels, hebben een groot specifiek oppervlak, hoge oppervlakteactiviteit en uitstekende mechanische eigenschappen. En het heeft een groot potentieel op het gebied van energieopslag, katalysatordragers en hoogwaardige composietmaterialen.
Correlatie tussen grafietstructuur en gebruik
De unieke structuur van grafiet bepaalt het brede gebruik ervan. Door zijn goede elektrische geleidbaarheid is het een elektrodemateriaal dat wordt gebruikt in batterijen en elektrolytische cellen. Hoge temperatuurstabiliteit en chemische inertheid maken het een vuurvast materiaal voor de staalindustrie. Door zijn smeerbaarheid kan het als smeermiddel dienen in de machinefabricage. In de lucht- en ruimtevaart worden grafietcomposieten gebruikt bij de productie van vliegtuig- en raketonderdelen vanwege hun lage dichtheid, hoge sterkte en thermische stabiliteit. Daarnaast speelt grafiet ook een belangrijke rol bij de productie van potloden, de bereiding van grafeen en andere toepassingen. En elke toepassing is nauw verbonden met de grafietstructuur.
Conclusie
De structuur van grafiet vertoont zijn uniekheid en complexiteit in meerdere dimensies, wat de prestaties en toepassing diepgaand beïnvloedt. Diepgaand onderzoek en inzicht in de structuur van grafiet opent brede perspectieven voor innovatieve toepassingen op vele gebieden, zoals materiaalwetenschap en energie. En dit helpt om de materiaal- en energieproblemen in de moderne samenleving te overwinnen.