Dans le système des éléments, l'atome de carbone occupe une position unique et importante, qui est la pierre angulaire de la vie. Il est non seulement à la base de toutes les formes de vie sur Terre, mais il est aussi le moteur de l'innovation dans la science des matériaux. En approfondissant la structure de l'atome de carbone, on peut comprendre la logique interne de l'origine de la vie et de l'innovation matérielle.
Informations de base sur le carbone
Numéro atomique, symbole chimique et masse atomique du carbone
Le numéro atomique du carbone est 6 et son symbole chimique est C. Le carbone étant présent dans la nature sous la forme de nombreux isotopes, sa masse atomique relative est calculée comme une moyenne basée sur l'abondance relative de chaque isotope, qui est d'environ 12,01.
Isotopes du carbone
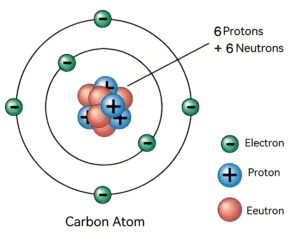
Dans la nature, le carbone se présente sous la forme de trois isotopes principaux : le carbone 12, le carbone 13 et le carbone 14. Le carbone 12 est le plus courant, représentant environ 98,93% de l'ensemble du carbone, dont le noyau contient six protons et six neutrons. Ces caractéristiques en font un étalon pour la définition des unités de masse atomique. Le carbone 13 représente environ 1,07% du noyau atomique et possède six protons et sept neutrons. Il est souvent utilisé dans la spectroscopie par résonance magnétique nucléaire (RMN) pour aider les scientifiques à étudier la structure moléculaire. Le carbone 14 est un isotope radioactif dont le noyau est constitué de six protons et de huit neutrons. Il a une demi-vie d'environ 5 730 ans et joue un rôle clé en archéologie. Les archéologues peuvent dater des objets en mesurant la quantité de carbone 14 qui se désintègre dans ces objets.
Analyse de la structure de l'atome de carbone
Modèles atomiques et développement théorique
Du modèle de la sphère solide de Dalton au modèle du plum-pudding de Thomson, en passant par le modèle nucléaire de Rutherford. Le modèle de l'orbite en couches de l'électron de Bohr et les modèles modernes de la mécanique quantique ont permis d'approfondir la compréhension de la structure atomique. Ces développements théoriques ont jeté les bases de la révélation de la structure des atomes de carbone. Les modèles modernes de mécanique quantique suggèrent que les électrons ne se déplacent pas sur des orbites fixes, mais qu'ils sont répartis autour du noyau dans un nuage de probabilité.
Détails de la structure atomique du carbone
Noyau atomique
Le noyau d'un atome de carbone est composé de protons et de neutrons. Les protons ont une charge positive et les neutrons sont électriquement neutres. En raison de la présence de protons, le noyau dans son ensemble est chargé positivement. Et comme le nombre de charges positives est égal au nombre de charges négatives portées par les électrons à l'extérieur du noyau, l'atome entier est électriquement neutre.
Électrons étrangers
Les atomes de carbone possèdent six électrons extranucléaires, qui sont répartis dans différentes couches d'électrons en fonction de leur niveau d'énergie. La première couche (couche K) contient jusqu'à deux électrons. La deuxième couche (couche L) contient jusqu'à huit électrons, et l'arrangement électronique des atomes de carbone est 2,4. Autrement dit, la couche K contient deux électrons et la couche L quatre électrons. Ces quatre électrons de valence confèrent à l'atome de carbone ses propriétés chimiques uniques, lui permettant de former des composés stables avec d'autres atomes.
Diverses structures de carbone
Allotropes du carbone
Diamant
Il s'agit d'un cristal dur, dont les atomes de carbone construisent, par le biais de liaisons covalentes, une structure tétraédrique tridimensionnelle, chaque atome de carbone reliant quatre atomes adjacents. Cette structure confère au diamant une dureté et un point de fusion extrêmement élevés, ce qui en fait le matériau de prédilection pour la coupe, le meulage et d'autres industries. En outre, son éclat brillant en fait une pierre précieuse.
Graphite
Il a une structure en couches et les atomes de carbone dans les couches forment un réseau hexagonal de liaisons covalentes. La combinaison de faibles forces de van der Waals entre les couches confère au graphite une bonne conductivité électrique et un bon pouvoir lubrifiant. Vous pouvez souvent utiliser graphite dans la fabrication d'électrodes, de lubrifiants et de mines de crayon.
Fullerènes et nanotubes de carbone
Fullerènes sont des molécules cages composées d'atomes de carbone, dont la plus célèbre est le C60, qui a la forme d'un ballon de football. Les nanotubes de carbone sont constitués d'atomes de carbone dans une structure tubulaire présentant d'excellentes propriétés de conductivité mécanique, électrique et thermique. Ils peuvent être utilisés pour fabriquer des matériaux composites et des appareils électroniques très performants.
Structures moléculaires du carbone
Structure moléculaire du dioxyde de carbone
La molécule de CO2 se compose d'un atome de carbone et de deux atomes d'oxygène. Les atomes de carbone et les atomes d'oxygène sont reliés par des doubles liaisons, en ligne droite. Cette structure rend le dioxyde de carbone gazeux à température et pression ambiantes. Il s'agit d'un élément important du cycle du carbone de la Terre et du principal gaz à effet de serre responsable du réchauffement climatique.
Composés organiques
Les composés organiques sont des composés contenant du carbone, à l'exclusion du monoxyde de carbone, du dioxyde de carbone et des carbonates. Les propriétés quadruvalentes des atomes de carbone lui permettent de former une variété de composés organiques avec l'hydrogène, l'oxygène, l'azote et d'autres atomes. Ils constituent la base des matériaux de la vie tels que les protéines et les acides nucléiques.
Concepts spéciaux dans les structures en carbone
Atomes de carbone tertiaire
Les atomes de carbone tertiaires relient trois atomes de carbone et ont une activité réactive particulière en chimie organique. Dans la réaction de substitution nucléophile des hydrocarbures halogénés, les hydrocarbures halogénés contenant des atomes de carbone tertiaires suivent principalement le mécanisme SN1. Cette propriété est différente de celle des hydrocarbures halogénés primaires et secondaires, qui sont largement utilisés en synthèse organique.
Structure atomique des fibres de carbone
Fibre de carbone est composé de microcristaux de graphite, dont les atomes sont disposés le long de l'axe axial de la fibre. Elle présente donc les avantages d'une grande résistance et d'une faible densité. Grâce à ces propriétés, elle peut être largement utilisée dans l'aérospatiale, la fabrication d'équipements sportifs et d'autres domaines.
Découverte et applications du carbone
Qui a découvert le carbone ?
Le carbone est l'un des premiers éléments découverts et utilisés par l'homme. Dès la préhistoire, l'homme utilise le charbon de bois comme combustible. Toutefois, ce n'est qu'au XVIIIe siècle que le chimiste français Lavoisier a prouvé expérimentalement que le carbone était un élément. En se basant sur le latin "carbo", il lui a donné le nom de "carbone", qui signifie charbon de bois.
Dix utilisations du carbone
Carburant
Lorsqu'ils sont brûlés, les combustibles à base de carbone, tels que le bois et le charbon, réagissent avec l'oxygène. Ils peuvent alors dégager de la chaleur pour le chauffage, la cuisine et la production d'électricité.
Production d'acier
Une quantité appropriée de carbone peut améliorer la résistance et la dureté de l'acier. En régulant la teneur en carbone, il est possible de produire différentes propriétés de l'acier et de l'utiliser pour la construction et la fabrication de machines.
Électrode en graphite
Électrode en graphite possède une bonne conductivité électrique et une bonne résistance aux températures élevées. Il peut être utilisé dans les liaisons conductrices des fours électriques, de la sidérurgie, de l'électrolyse de l'aluminium et d'autres industries.
Mine de crayon
La mine de crayon est composée de graphite mélangé à de l'argile, et la structure de la couche de graphite lui permet de laisser des traces sur le papier lors de l'écriture.
Adsorption sur charbon actif
Le charbon actif possède de nombreux pores et une grande surface spécifique, ce qui lui permet d'absorber les impuretés et les substances nocives. Il peut être utilisé pour la purification de l'eau et de l'air, entre autres.
Bijoux en diamant
Le diamant est un allotrope du carbone, qui présente un éclat brillant et une grande dureté, et qui est souvent utilisé en bijouterie.
Matériau en fibre de carbone
Il est utilisé dans l'aérospatiale et la fabrication d'équipements sportifs pour réduire le poids et améliorer les performances.
Renforcement du caoutchouc
L'ajout de noir de carbone au caoutchouc permet d'améliorer sa solidité, sa résistance à l'usure et au vieillissement, ce qui est principalement utilisé dans la fabrication des pneus.
Conservation des aliments
Le charbon actif peut absorber les odeurs et les gaz nocifs dans les emballages alimentaires et prolonger la durée de conservation des aliments.
Produits électroniques
Le carbone est également largement utilisé dans les produits électroniques, comme le graphène. Il possède d'excellentes propriétés électriques et devrait être utilisé dans les futurs appareils électroniques.
Conclusion
L'atome de carbone a une structure unique, une nature riche et de nombreuses applications. Il a été découvert depuis les matériaux de base de la vie jusqu'aux matériaux scientifiques et technologiques de pointe. L'étude approfondie de la structure des atomes de carbone a favorisé le développement de la société humaine et contribué à créer un avenir meilleur.