El grafito, como alótropo clave del carbono, desempeña un papel importante en muchos campos. La exploración en profundidad de su estructura es la clave para desentrañar el amplio potencial de aplicación del grafeno y el desarrollo de nuevos materiales.
Índice
Toggle
¿Qué es el grafito?
El grafito, un mineral formado por átomos de carbono, está ampliamente distribuido en la naturaleza. Tiene un brillo metálico y un tacto suave y liso. Por eso es un material ideal para las minas de los lápices. El color del grafito es mayoritariamente negro o gris oscuro. Y su pureza y grado de cristalización varían según el entorno de formación.
Estructura atómica y molecular del grafito
Estructura atómica del grafito
La composición principal del grafito es el carbono. Los átomos de carbono del grafito están conectados por enlaces covalentes. Y cada átomo de carbono y los tres átomos de carbono circundantes forman una estructura de anillo hexagonal estable, que se extiende indefinidamente en el plano para formar un esqueleto atómico sólido.
Estructura molecular del grafito
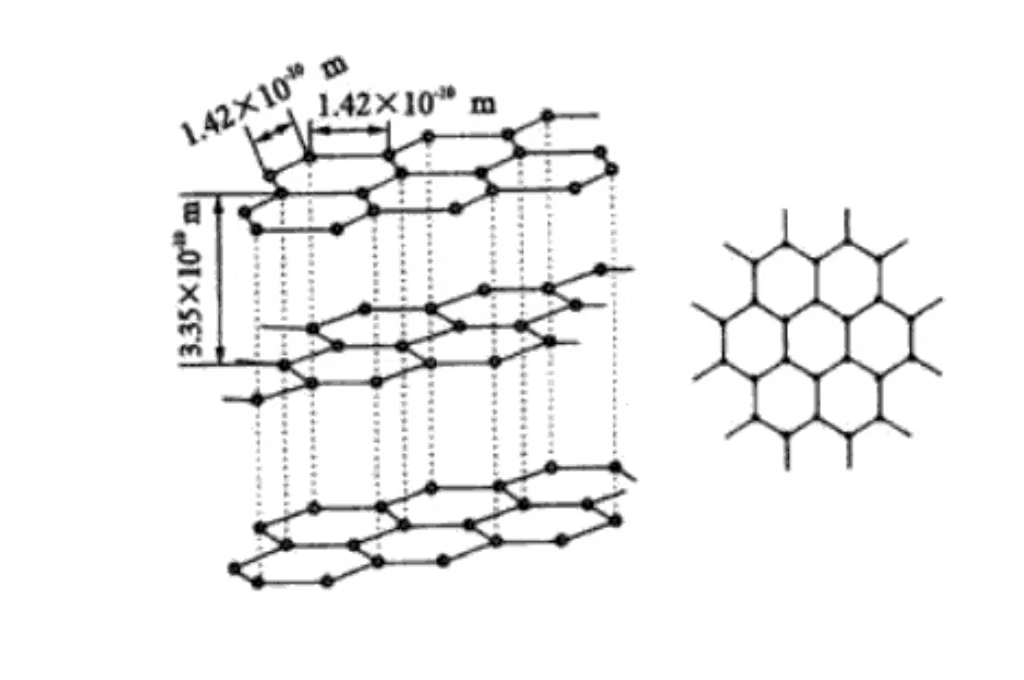
A nivel molecular, el grafito está formado por capas de átomos de carbono apilados unos sobre otros. Los átomos de carbono entre capas se mantienen por fuerzas de Van der Waals relativamente débiles. Y esta estructura en capas explica la excelente lubricidad del grafito y su fácil deslizamiento entre capas.
Dos elementos clave de la estructura del grafito
Estructura cristalina hexagonal del grafito
Arreglos
El grafito tiene una estructura cristalina hexagonal, los átomos de carbono están dispuestos estrechamente en hexágonos en el plano, incluyendo un ángulo de 120 grados. La disposición es regular y estable, propicia la conducción de electrones, es la base de su buena conductividad eléctrica.
Capas
Los átomos de carbono están apilados en planos paralelos, la separación entre capas es de unos 0,335 nm. Y la fuerza de van der Waals entre las capas es débil, lo que hace que el grafito se deslice fácilmente entre las capas externas y tenga lubricabilidad. Se utiliza habitualmente como lubricante en el campo de la fabricación mecánica.
Capas de la estructura cristalina
Cada capa de átomos de carbono forma un plano de red mediante enlaces covalentes. Esto se dispone de forma ordenada en el espacio, dando las características cristalinas macroscópicas y la anisotropía del grafito. El fuerte enlace covalente en la capa hace que el grafito tenga una gran resistencia y dureza en el plano. La dirección vertical del plano tiene baja resistencia debido a la débil fuerza entre capas.
Enlaces entre átomos de carbono
Fuerzas Van der Waal
Los átomos de carbono entre capas dependen de la fuerza de van der Waals, que es débil, lo que facilita la separación por deslizamiento entre las capas de grafito y la lubricidad. Pero también hace que la estructura entre capas del grafito sea variable en determinadas condiciones (como alta temperatura y presión). Por ejemplo, puede transformarse en una estructura de diamante.
Separación de capas
Debido a la débil fuerza de Van der Waals, la capa de grafito puede separarse aplicando una pequeña fuerza de cizallamiento. Esto no sólo refleja la lubricidad, sino que también crea la posibilidad de reacciones de intercalación, a través de las cuales se pueden cambiar las propiedades físicas y químicas del grafito para preparar materiales compuestos especiales. Por ejemplo, materiales de electrodos negativos para baterías de iones de litio.
Enlaces covalentes
Los átomos de carbono de la capa están estrechamente unidos por enlaces covalentes para formar una estructura hexagonal estable. Esto determina la gran dureza y resistencia del grafito en el plano, garantiza su estabilidad estructural en la aplicación de materiales para electrodos. Y limita el movimiento de los electrones, afectando a la anisotropía en el plano.
Hibridación Sp2
Ángulo de enlace
Los átomos de carbono adoptan la hibridación sp2, un orbital 2s y dos 2p se hibridan para formar tres orbitales de hibridación sp2 equivalentes. Estos se distribuyen en un triángulo plano con un ángulo de unos 120 grados. De este modo, los átomos de carbono forman enlaces covalentes estables con tres átomos de carbono adyacentes para construir una estructura hexagonal, que favorece la conducción por deslocalización de electrones y una buena conductividad eléctrica.
Átomos de carbono
El átomo de carbono construye un esqueleto plano con tres átomos de carbono circundantes mediante orbitales híbridos sp2. Y los planos verticales de los orbitales 2p no híbridos se solapan para formar nubes de electrones π deslocalizados. Las nubes de electrones π confieren al grafito una buena conductividad eléctrica, en la que los electrones pueden moverse libremente en respuesta a cambios en los campos eléctricos. Y hacen que el grafito sea activo en reacciones químicas y participe en procesos electroquímicos. Por ejemplo, como medio de transferencia de electrones en las baterías de iones de litio.
Anisotropía
Atributos en el plano y fuera del plano
El grafito muestra una importante anisotropía en distintas direcciones. En el plano, el enlace covalente es fuerte, con alta dureza, resistencia y buena conductividad eléctrica. Por ejemplo, se pueden utilizar materiales compuestos reforzados con fibra de grafito como fase de refuerzo para aprovechar su resistencia a la tracción en el plano. En la dirección del plano vertical, debido a la débil fuerza de van der Waals entre capas, tiene poca resistencia y escasa conductividad. Esta característica le confiere una ventaja específica en diferentes escenarios de aplicación.
Acuerdos sobre energía atómica
Los átomos de carbono del grafito se disponen según una ley específica, formando hexágonos en el plano y apilando capas en el espacio. Esta disposición determina la estructura cristalina y las propiedades físicas y químicas. La difracción de rayos X puede determinar la cristalinidad y los parámetros estructurales según el patrón específico que presenta su disposición ordenada. Y la estabilidad de la disposición atómica hace que el grafito mantenga un rendimiento estable en un determinado rango de temperatura y presión. Por ejemplo, el grafito como material refractario a alta temperatura puede garantizar la integridad de la estructura, proporcionando protección para la fiabilidad de las aplicaciones industriales.
Estructura reticular y cristalina del grafito
Estructura reticular del grafito
El grafito tiene una estructura reticular hexagonal, el eje a y el eje b tienen la misma longitud. Y el ángulo es de 120 grados, el eje c es perpendicular al plano del átomo de carbono. Su longitud refleja la disposición periódica de la estructura en capas, pertenece al sistema cristalino hexagonal, con simetría y características cristalográficas específicas.
Estructura cristalina del grafito
El cristal de grafito está formado por numerosas unidades de red hexagonal dispuestas de forma ordenada en el espacio. Y los átomos de carbono internos están dispuestos de forma muy ordenada. Y sus defectos e impurezas cambiarán significativamente su rendimiento, afectando al transporte de electrones y fonones, a las reacciones químicas y a la uniformidad del material.
Tres defectos comunes en la estructura del grafito
Los defectos de la estructura del grafito tienen una gran influencia en su rendimiento.
Los defectos puntuales, como las vacantes y los átomos libres, destruirán la integridad atómica y afectarán a la conducción de electrones y a las propiedades mecánicas.
Los defectos lineales, como la dislocación, afectan a la deformación plástica y a la resistencia.
Los defectos superficiales, como el límite de grano, dificultan la transmisión de electrones y fonones, reducen la conductividad y la conductividad térmica. Además, provocan fácilmente reacciones químicas y la agregación de impurezas.
Conceptos relacionados con la estructura del grafito
Grafito Estructura de Lewis
La estructura de Lewis del grafito muestra el reparto de electrones entre los átomos de carbono, y satisface la estructura estable de ocho electrones mediante la formación de enlaces covalentes con los átomos de carbono vecinos. Los electrones no implicados forman nubes de electrones π deslocalizados. Esto proporciona la base para comprender el enlace químico y la distribución de electrones.
Hibridación del grafeno
La hibridación sp2 de los átomos de carbono del grafito es la raíz de su estructura y propiedades únicas. Esto da lugar a una estructura plana, deslocalizada π-electrón nube, dando grafito una variedad de excelentes propiedades.
Símbolos y fórmulas del grafito
El símbolo químico del grafito es "C". Aunque es difícil expresar la estructura macromolecular con una fórmula molecular simple, pero en el cálculo químico y la fórmula de reacción. "C" puede representar la reacción del grafito, reflejando la transformación y conservación del carbono.
Estructura y enlace del grafito
La estructura en capas y las propiedades superficiales del grafito son de gran importancia para sus propiedades de enlace. La fuerza de Van der Waals entre capas es débil, por lo que es necesario modificar la superficie del grafito o seleccionar un aglutinante adecuado para mejorar la interacción. La modificación de la superficie puede introducir grupos funcionales o un tratamiento de coarsening. Además, los grupos polares del aglutinante pueden unirse fuertemente a los átomos de carbono de la superficie del grafito. En los materiales compuestos, un buen rendimiento de la unión es la clave para garantizar las propiedades mecánicas y funcionales generales. Una unión deficiente puede provocar la concentración de tensiones interfaciales y, en consecuencia, el fallo del material.
Explique la diferencia entre la estructura del grafito y la de otros materiales
Estructura del grafito frente a la del grafeno
En realidad, grafeno representa una capa de grafito de un átomo de espesor. En cada lámina de grafito de 1 mm de grosor hay unos 3 millones de capas de grafeno apiladas unas sobre otras. El grafeno puede considerarse una capa de grafito, mientras que el grafito está formado por varias capas de grafeno superpuestas.
Comparación de la estructura del grafito y el diamante
Diferencias estructurales
Los átomos de carbono del diamante adoptan la hibridación sp3 para formar una estructura espacial tetraédrica, y los enlaces covalentes entre átomos son muy fuertes. El grafito es hexagonal plano híbrido sp2 y en capas, con débiles fuerzas de van der Waals entre las capas.
Diferencias de rendimiento
Las diferencias estructurales se traducen en claras diferencias de rendimiento. La dureza del diamante es muy alta y se utiliza en el mecanizado; el grafito tiene una textura blanda y buena lubricidad, por lo que se utiliza como lubricante y mina de lápiz. El grafito conduce la electricidad, el diamante apenas. El diamante tiene un alto índice de refracción y transparencia, se utiliza en joyería; el grafito es negro y opaco.
Tipos de estructura del grafito
Grafito natural
Suele aparecer en esquistos grafitosos, gneis grafitosos, esquistos grafitosos y esquistos metamórficos. Según su forma cristalina, grafito natural puede dividirse simultáneamente en dos variedades: el grafito cristalino -que a su vez se divide en grafito en escamas- y el grafito criptocristalino, también conocido como grafito terroso.
Grafito sintético
Grafito sintético es un tipo de producto químico. Su principal ingrediente es el carbono. Se obtiene por pirólisis a alta temperatura y grafitización de polímeros orgánicos.
Estructuras especiales de grafito, como el grafito expandible y las estructuras de nanografito. El grafito expandible mediante tratamiento especial, material de inserción entre capas, descomposición y expansión a alta temperatura, con buen retardante de llama, se utiliza para materiales ignífugos. Las estructuras de nano-grafito, como las láminas de nano-grafito y las fibras de nano-grafito, tienen una gran superficie específica, alta actividad superficial y excelentes propiedades mecánicas. Y tiene un gran potencial en los campos del almacenamiento de energía, los portadores de catalizadores y los materiales compuestos de alto rendimiento.
Correlación entre la estructura del grafito y su uso
La estructura única del grafito determina su amplio uso. Su buena conductividad eléctrica lo convierte en un material de electrodos, que se utiliza en baterías y celdas electrolíticas. Su estabilidad a altas temperaturas y su inercia química lo convierten en un refractario para la industria siderúrgica. Su lubricidad le permite actuar como lubricante en la fabricación de maquinaria. En el campo aeroespacial, los compuestos de grafito se utilizan en la fabricación de componentes de aviones y cohetes debido a su baja densidad, alta resistencia y estabilidad térmica. Además, el grafito también desempeña un papel importante en la fabricación de lápices, la preparación de grafeno y otros campos. Y cada aplicación está estrechamente ligada a la estructura del grafito.
Conclusión
La estructura del grafito muestra su singularidad y complejidad desde múltiples dimensiones, lo que afecta profundamente a su rendimiento y aplicación. La investigación y comprensión en profundidad de la estructura del grafito abre amplias perspectivas para su aplicación innovadora en muchos campos, como la ciencia de los materiales y la energía. Y esto ayuda a superar los problemas materiales y energéticos de la sociedad moderna.