Графіт, як ключовий алотроп вуглецю, відіграє важливу роль у багатьох галузях. Поглиблене вивчення його структури є ключем до розкриття широкого потенціалу застосування графіту та розробки нових матеріалів.
Зміст
Перемикач
Що таке графіт?
Графіт, мінерал, що складається з атомів вуглецю, широко розповсюджений у природі. Він має металевий блиск і м'який та гладкий на дотик. Це робить його ідеальним матеріалом для грифелів олівців. Колір графіту переважно чорний або темно-сірий. А його чистота і ступінь кристалізації варіюються в залежності від середовища формування.
Атомна та молекулярна будова графіту
Атомна будова графіту
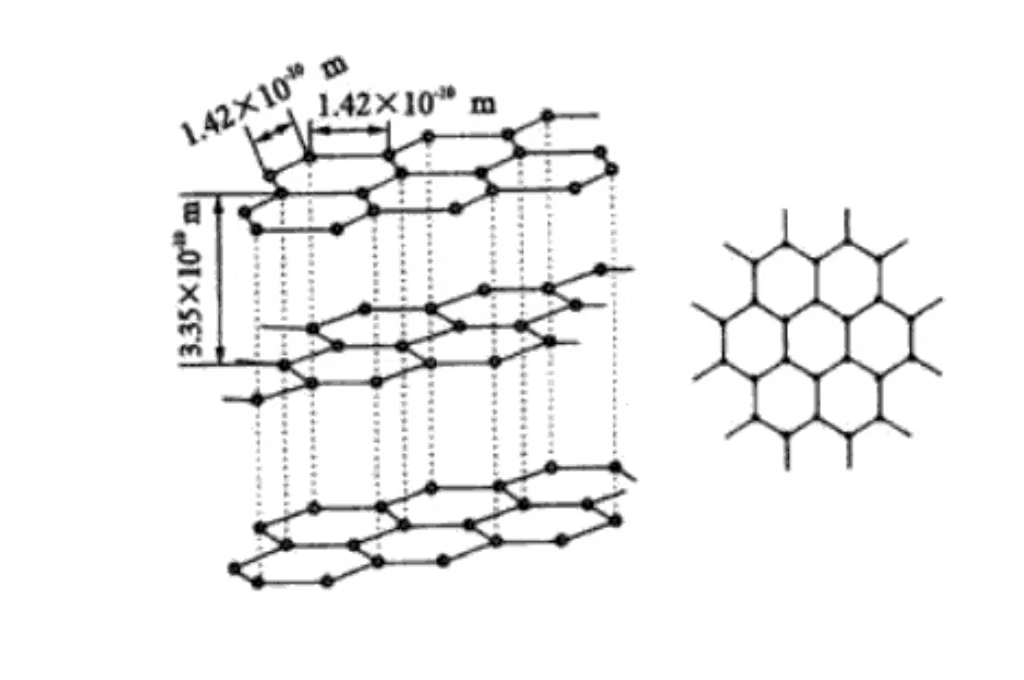
Основний склад графіту - вуглець. Атоми вуглецю в графіті з'єднані ковалентними зв'язками. Кожен атом вуглецю і три сусідні атоми вуглецю утворюють стійку шестикутну кільцеву структуру, яка простягається в площині до нескінченності, утворюючи твердий атомний скелет.
Молекулярна структура графіту
На молекулярному рівні графіт складається з шари атомів вуглецю, розташованих один над одним. Міжшарові атоми вуглецю підтримуються відносно слабкими силами Ван-дер-Ваальса. І ця шарувата структура пояснює, чому графіт має чудову змащувальну здатність і легко ковзає між шарами.
Два ключові елементи структури графіту
Гексагональна кристалічна структура графіту
Домовленості
Графіт має гексагональну кристалічну структуру, атоми вуглецю тісно розташовані в шестикутниках на площині, включаючи кут 120 градусів. Таке розташування є регулярним і стабільним, сприятливим для проведення електронів, що є основою його гарної електропровідності.
Нашарування
Атоми вуглецю розташовані в паралельних площинах, відстань між шарами становить близько 0,335 нм. Сила Ван-дер-Ваальса між шарами слабка, тому графіт легко ковзає між зовнішніми шарами і має змащувальні властивості. Він зазвичай використовується як мастило в галузі механічного виробництва.
Шари кристалічної структури
Кожен шар атомів вуглецю утворює сітчасту площину за допомогою ковалентних зв'язків. Це впорядковано розташовується в просторі, надаючи макроскопічні кристалічні характеристики та анізотропію графіту. Сильний ковалентний зв'язок у шарі надає графіту високу міцність і твердість у площині. Вертикальний напрямок площини має низьку міцність через слабку міжшарову силу.
Зв'язки між атомами вуглецю
Сили Ван дер Ваала
Міжшарові атоми вуглецю покладаються на силу Ван-дер-Ваальса, яка є слабкою, що призводить до легкого ковзного розділення між шарами графіту і мастилом. Але це також робить міжшарову структуру графіту мінливою за певних умов (таких як висока температура і тиск). Наприклад, вона може трансформуватися в алмазну структуру.
Розділення шарів
Завдяки слабкій силі Ван-дер-Ваальса графітовий шар можна відокремити за допомогою невеликого зусилля зсуву. Це не тільки відображає мастило, але й створює можливість реакцій інтеркаляції, завдяки яким фізичні та хімічні властивості графіту можуть бути змінені для підготовки спеціальних композитних матеріалів. Наприклад, матеріали негативних електродів для літій-іонних акумуляторів.
Ковалентні облігації
Атоми вуглецю в шарі щільно з'єднані ковалентними зв'язками, утворюючи стабільну гексагональну структуру. Це визначає високу твердість і міцність графіту в площині, гарантує його структурну стабільність при застосуванні електродних матеріалів. І обмежує рух електронів, впливаючи на анізотропію в площині.
Sp2 гібридизація
Кут зв'язку
Атоми вуглецю приймають sp2 гібридизацію, одна 2s і дві 2p орбіталі гібридизуються, утворюючи три еквівалентні sp2 гібридизаційні орбіталі. Вони розподілені в плоскому трикутнику з кутом близько 120 градусів. Таким чином, атоми вуглецю утворюють стабільні ковалентні зв'язки з трьома сусідніми атомами вуглецю для побудови гексагональної структури, що сприяє делокалізаційній провідності електронів і хорошій електропровідності.
Атоми вуглецю
Атом вуглецю утворює плоский каркас з трьома оточуючими атомами вуглецю через sp2 гібридні орбіталі. А вертикальні площини негібридних 2p-орбіталей перекриваються, утворюючи делокалізовані π-електронні хмари. π-електронні хмари надають графіту хорошу електропровідність, в якій електрони можуть вільно рухатися у відповідь на зміни електричних полів. І роблять графіт активним у хімічних реакціях та беруть участь в електрохімічних процесах. Наприклад, як середовище для перенесення електронів у літій-іонних акумуляторах.
Анізотропія
Атрибути в площині та поза площиною
Графіт демонструє значну анізотропію в різних напрямках. У площині ковалентний зв'язок міцний, з високою твердістю, міцністю і хорошою електропровідністю. Наприклад, ви можете використовувати композитні матеріали, армовані графітовим волокном, в якості армуючої фази, щоб використовувати його міцність на розрив в площині. У напрямку вертикальної площини, через слабку міжшарову силу Ван-дер-Ваальса, низьку міцність і погану провідність. Ця характеристика робить його цілеспрямованою перевагою в різних сценаріях застосування.
Домовленості з атомної енергетики
Атоми вуглецю в графіті розташовуються за певним законом, утворюючи шестикутники на площині та шари в просторі. Таке розташування визначає кристалічну структуру та фізико-хімічні властивості. Рентгенівська дифракція може визначити кристалічність і структурні параметри відповідно до конкретного шаблону, представленого його впорядкованим розташуванням. А стабільність атомного розташування змушує графіт підтримувати стабільні характеристики в певному діапазоні температур і тиску. Наприклад, графіт як вогнетривкий матеріал при високій температурі може забезпечити цілісність структури, забезпечуючи захист для надійності промислових застосувань.
Кристалічна структура графіту та його ґратки
Структура кристалічної решітки графіту
Графіт має гексагональну структуру решітки, осі a і b мають однакову довжину. Кут а становить 120 градусів, вісь с перпендикулярна до площини атома вуглецю. Його довжина відображає періодичне розташування шаруватої структури, належить до гексагональної кристалічної системи, зі специфічною симетрією та кристалографічними характеристиками.
Кристалічна структура графіту
Кристал графіту складається з численних одиниць гексагональної решітки, впорядковано розташованих у просторі. А внутрішні атоми вуглецю розташовані дуже впорядковано. І дефекти та домішки суттєво змінюють його характеристики, впливаючи на транспорт електронів і фононів, хімічні реакції та однорідність матеріалу.
Три поширені дефекти в структурі графіту
Дефекти в структурі графіту мають великий вплив на його характеристики.
Точкові дефекти, такі як вакансії та вільні атоми, руйнують атомну цілісність і впливають на електронну провідність та механічні властивості.
Лінійні дефекти, такі як дислокація, впливають на пластичну деформацію та міцність.
Поверхневі дефекти, такі як межі зерен, перешкоджають передачі електронів і фононів, знижують електропровідність і теплопровідність. А це легко призводить до хімічних реакцій та агрегації домішок.
Поняття, пов'язані зі структурою графіту
Структура графіту Льюїса
Структура Льюїса графіту демонструє розподіл електронів між атомами вуглецю і задовольняє восьмиелектронну стабільну структуру, утворюючи ковалентні зв'язки з сусідніми атомами вуглецю. Незадіяні електрони утворюють делокалізовані π-електронні хмари. Це дає основу для розуміння хімічного зв'язку та розподілу електронів.
Гібридизація графіту
Гібридизація sp2 атомів вуглецю в графіті лежить в основі його унікальної структури та властивостей. Це призводить до утворення планарної структури, делокалізованої π-електронної хмари, що надає графіту різноманітних чудових властивостей.
Графітні символи та формули
Хімічний символ графіту - "С". Хоча макромолекулярну структуру важко виразити простою молекулярною формулою, але в хімічних розрахунках і формулі реакції. "С" може представляти реакцію графіту, що відображає перетворення і збереження вуглецю.
Структура та зв'язок графіту
Шарувата структура і властивості поверхні графіту мають велике значення для його сполучних властивостей. Міжшарова сила Ван-дер-Ваальса слабка, тому необхідно модифікувати поверхню графіту або підібрати відповідну сполучну речовину, щоб посилити взаємодію. Модифікація поверхні може вводити функціональні групи або обробку огрубіння. А полярні групи сполучного можуть міцно зв'язуватися з атомами вуглецю на поверхні графіту. У композитних матеріалах хороші показники зчеплення є ключем до гарантування загальних механічних і функціональних властивостей. А погане зчеплення легко викликає концентрацію міжфазних напружень, що призводить до руйнування матеріалу.
Поясніть різницю між структурою графіту та іншими матеріалами
Структура графіту проти структури графену
Взагалі-то, графен являє собою шар графіту завтовшки в один атом. У кожному листі графіту товщиною 1 мм є близько 3 мільйонів шарів графену, розташованих один над одним. Графен можна розглядати як один шар графіту, тоді як графіт складається з декількох шарів графену, розташованих один над одним.
Порівняння структури графіту та алмазу
Структурні відмінності
Атоми вуглецю алмазу приймають sp3 гібридизацію, утворюючи тетраедричну просторову структуру, а ковалентні зв'язки між атомами дуже міцні. Графіт має sp2-гібридну планарну гексагональну шарувату структуру зі слабкими силами Ван-дер-Ваальса між шарами.
Відмінності в продуктивності
Структурні відмінності призводять до чітких відмінностей у продуктивності. Твердість алмазу дуже висока, використовується в механічній обробці; графіт має м'яку текстуру, хорошу змащувальну здатність, використовується як мастило і грифель для олівців. Графіт проводить електрику, алмаз майже не проводить. Алмаз з високим показником заломлення і прозорістю, використовується в ювелірних виробах; графіт чорний і непрозорий.
Типи структури графіту
Природний графіт
Зазвичай він зустрічається в графітових сланцях, графітових гнейсах, графітовмісних сланцях і метаморфічних сланцях. За кристалічною формою, природний графіт можна одночасно розділити на два різновиди: кристалічний графіт, який поділяється на лускатий графіт і криптокристалічний графіт, також відомий як землистий графіт.
Синтетичний графіт
Синтетичний графіт це різновид хімічного продукту. Його основним інгредієнтом є вуглець. Його отримують шляхом високотемпературного піролізу та графітизації органічних полімерів.
Спеціальні графітові структури, такі як графіт, що розширюється, і нанографітові структури. Розширюваний графіт за допомогою спеціальної обробки, міжшарового вставного матеріалу, розкладання і розширення при високій температурі, з хорошими антипіренами, використовується для вогнетривких матеріалів. Нанографітові структури, такі як нанографітові листи та нанографітові волокна, мають велику питому поверхню, високу поверхневу активність та відмінні механічні властивості. І він має великий потенціал у галузі зберігання енергії, носіїв каталізаторів та високоефективних композитних матеріалів.
Взаємозв'язок між структурою графіту та його використанням
Унікальна структура графіту зумовлює його широке застосування. Хороша електропровідність робить його електродним матеріалом, який використовується в акумуляторах та електролітичних елементах. Висока термостійкість і хімічна інертність роблять його вогнетривом для сталеливарної промисловості. Змащувальні властивості дозволяють використовувати його як мастило у машинобудуванні. В аерокосмічній галузі графітові композити використовуються у виробництві компонентів літаків і ракет завдяки їхній низькій щільності, високій міцності та термостійкості. Крім того, графіт також відіграє важливу роль у виробництві олівців, підготовці графену та інших сферах. І кожне застосування тісно пов'язане зі структурою графіту.
Висновок
Структура графіту демонструє його унікальність і складність з багатьох вимірів, що глибоко впливає на характеристики і застосування. Поглиблене дослідження та розуміння структури графіту відкриває широкі перспективи для його інноваційного застосування в багатьох галузях, таких як матеріалознавство та енергетика. А це допомагає подолати матеріальні та енергетичні проблеми сучасного суспільства.