В системе элементов атом углерода занимает уникальное и важное положение, являясь краеугольным камнем жизни. Он не только лежит в основе всех форм жизни на Земле, но и является движущей силой инноваций в материаловедении. Углубление в структуру атома углерода может дать представление о внутренней логике зарождения жизни и материальных инноваций.
Основные сведения об углероде
Атомный номер, химический символ и атомная масса углерода
Атомный номер углерода - 6, а химический символ - C. Поскольку углерод встречается в природе в виде множества изотопов, его относительная атомная масса рассчитывается как среднее значение, основанное на относительной распространенности каждого изотопа, которая составляет примерно 12,01.
Изотопы углерода
В природе углерод встречается в виде трех основных изотопов: углерод-12, углерод-13 и углерод-14. Наиболее распространен углерод-12, составляющий около 98,93% всего углерода, ядро которого содержит шесть протонов и шесть нейтронов. Это делает его стандартом для определения единиц атомной массы. Углерод-13 составляет около 1,07% атомного ядра и имеет шесть протонов и семь нейтронов. Его часто используют в спектроскопии ядерного магнитного резонанса (ЯМР), чтобы помочь ученым изучить структуру молекул. Углерод-14 - радиоактивный изотоп с ядром, состоящим из шести протонов и восьми нейтронов. Его период полураспада составляет около 5 730 лет, и он играет ключевую роль в археологии. Археологи могут датировать артефакты, измеряя количество распадающегося в них углерода-14.
Анализ структуры атомов углерода
Атомные модели и развитие теории
От модели твердой сферы Дальтона, модели сливового пудинга Томсона и ядерной модели Резерфорда. А также модель слоистых орбит Бора и современные квантово-механические модели углубили понимание человеком структуры атома. Эти теоретические разработки заложили основу для раскрытия структуры атомов углерода. А современные квантово-механические модели предполагают, что электроны не движутся по фиксированным орбитам, а распределяются вокруг ядра в облаке вероятности.
Детали атомной структуры углерода
Атомное ядро
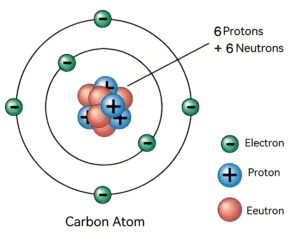
Ядро атома углерода состоит из протонов и нейтронов, причем протоны имеют положительный заряд, а нейтроны электрически нейтральны. Благодаря наличию протонов ядро в целом заряжено положительно. А поскольку количество положительных зарядов равно количеству отрицательных зарядов, которые несут электроны вне ядра, весь атом является электрически нейтральным.
Посторонние электроны
Атомы углерода имеют шесть внеядерных электронов, которые распределены по различным электронным слоям в соответствии с их энергетическими уровнями. Первый слой (K-слой) содержит до двух электронов. Второй слой (L-слой) вмещает до восьми электронов, а электронное расположение атомов углерода - 2,4. То есть в слое K два электрона, а в слое L - четыре. Эти четыре валентных электрона придают атому углерода уникальные химические свойства, позволяя ему образовывать устойчивые соединения с другими атомами.
Разнообразные структуры углерода
Аллотропы углерода
Алмаз
Это твердый кристалл, атомы углерода через ковалентные связи образуют трехмерную тетраэдрическую структуру, каждый атом углерода соединяет 4 соседних атома. Это придает алмазу сверхвысокую твердость и температуру плавления, делая его предпочтительным материалом для резки, шлифовки и других отраслей промышленности. Кроме того, яркий блеск делает его драгоценным камнем.
Графит
Он имеет слоистую структуру, а атомы углерода в слое образуют гексагональную сеть ковалентных связей. Благодаря сочетанию слабых ван-дер-ваальсовых сил между слоями графит обладает хорошей электропроводностью и смазывающей способностью. И вы можете часто использовать графит в производстве электродов, смазок и грифелей для карандашей.
Фуллерены и углеродные нанотрубки
Фуллерены это клетчатые молекулы, состоящие из атомов углерода, и самая известная из них - C60, по форме напоминающая футбольный мяч. Углеродные нанотрубки состоят из атомов углерода в трубчатой структуре с отличными механическими, электрическими и теплопроводными свойствами. Их можно использовать для создания высокоэффективных композитных материалов и электронных устройств.
Молекулярные структуры углерода
Молекулярная структура диоксида углерода
Молекула CO2 состоит из 1 атома углерода и 2 атомов кислорода, атомы углерода и кислорода соединены двойными связями, расположенными по прямой линии. Благодаря такой структуре углекислый газ находится в газообразном состоянии при комнатной температуре и давлении. Он является важной частью углеродного цикла Земли и основным парниковым газом, ответственным за глобальное потепление.
Органические соединения
Органические соединения - это соединения, содержащие углерод, но не включающие в себя угарный газ, диоксид углерода и карбонаты. Четырехвалентные свойства атомов углерода позволяют ему образовывать разнообразные органические соединения с водородом, кислородом, азотом и другими атомами. Они составляют основу жизненных материалов, таких как белки и нуклеиновые кислоты.
Специальные концепции в углеродных структурах
Третичные атомы углерода
Третичные атомы углерода соединяют три атома углерода и обладают особой реакционной активностью в органической химии. В реакции нуклеофильного замещения галогенированных углеводородов галогенированные углеводороды, содержащие третичные атомы углерода, в основном протекают по механизму SN1. Это свойство отличается от первичных и вторичных галогенированных углеводородов, которые широко используются в органическом синтезе.
Атомная структура углеродных волокон
Углеродное волокно состоит из микрокристаллов графита, атомы которых расположены вдоль осевой оси волокна. Благодаря этому оно обладает высокой прочностью и низкой плотностью. Благодаря этим свойствам его можно широко использовать в аэрокосмической промышленности, производстве спортивного оборудования и других областях.
Открытие и применение углерода
Кто открыл углерод
Углерод - один из первых элементов, открытых и использованных человеком. Еще в доисторические времена люди использовали древесный уголь в качестве топлива. Однако только в XVIII веке французский химик Лавуазье экспериментально доказал, что углерод - это элемент. И, основываясь на латинском "carbo", он дал ему название "карбон", что означает древесный уголь.
Десять способов использования углерода
Топливо
При сгорании углеродное топливо, такое как древесина и уголь, вступает в реакцию с кислородом. Затем из него может выделяться тепло для отопления, приготовления пищи и выработки электроэнергии.
Производство стали
Соответствующее количество углерода может повысить прочность и твердость стали. Регулируя содержание углерода, можно получать различные свойства стали и использовать ее в строительстве и машиностроении.
Графитовый электрод
Графитовый электрод обладает хорошей электропроводностью и высокой термостойкостью. Вы можете использовать его в проводящих звеньях электропечей сталеплавильного производства, электролитического производства алюминия и других отраслях промышленности.
Карандашный грифель
Грифель карандаша изготовлен из графита, смешанного с глиной, а структура графитового слоя позволяет ему оставлять следы на бумаге при письме.
Адсорбция активированным углем
Активированный уголь имеет богатые поры, большую удельную поверхность, которая может поглощать примеси и вредные вещества. Его можно использовать для очистки воды, воздуха и в других сферах.
Бриллиантовые украшения
Алмаз - аллотроп углерода, обладающий ярким блеском, высокой твердостью, из него часто делают ювелирные украшения.
Материал из углеродного волокна
Обладает высокой прочностью и низкой плотностью, используется в аэрокосмической промышленности и производстве спортивного оборудования для снижения веса и улучшения эксплуатационных характеристик.
Усиление резины
Добавление сажи в резину позволяет повысить ее прочность, износостойкость и устойчивость к старению, что в основном используется в производстве шин.
Сохранение продуктов питания
Активированный уголь может поглощать запахи и вредные газы в пищевой упаковке и продлевать срок хранения продуктов.
Электронные продукты
Углерод также широко используется в электронных изделиях, например, в графене. Он обладает превосходными электрическими свойствами и, как ожидается, будет использоваться в будущих электронных устройствах.
Заключение
Атом углерода имеет уникальную структуру, богатую природу и широкое применение. Он нашел применение в самых разных областях - от основных материалов для жизни до передовых научно-технических материалов. Глубокое изучение структуры атомов углерода способствовало развитию человеческого общества и помогло создать лучшее будущее.