Ο γραφίτης, ως βασικό αλλότροπο του άνθρακα, διαδραματίζει σημαντικό ρόλο σε πολλούς τομείς. Η σε βάθος διερεύνηση της δομής του είναι το κλειδί για την αποκάλυψη των ευρέων δυνατοτήτων εφαρμογής του γραφίτη και την ανάπτυξη νέων υλικών.
Πίνακας περιεχομένων
Εναλλαγή
Τι είναι ο γραφίτης;
Ο γραφίτης, ένα ορυκτό που αποτελείται από άτομα άνθρακα, είναι ευρέως διαδεδομένο στη φύση. Έχει μεταλλική λάμψη και απαλή και λεία αίσθηση. Αυτό τον καθιστά ιδανικό υλικό για μολυβδόβουλους. Το χρώμα του γραφίτη είναι ως επί το πλείστον μαύρο ή σκούρο γκρι. Και η καθαρότητα και ο βαθμός κρυστάλλωσής του ποικίλλουν ανάλογα με το περιβάλλον σχηματισμού.
Ατομική και μοριακή δομή του γραφίτη
Ατομική δομή του γραφίτη
Η κύρια σύνθεση του γραφίτη είναι ο άνθρακας. Τα άτομα άνθρακα στο γραφίτη συνδέονται με ομοιοπολικούς δεσμούς. Και κάθε άτομο άνθρακα και τα τρία άτομα άνθρακα που το περιβάλλουν σχηματίζουν μια σταθερή δομή εξαγωνικού δακτυλίου, η οποία εκτείνεται επ' άπειρον στο επίπεδο σχηματίζοντας έναν στερεό ατομικό σκελετό.
Μοριακή δομή του γραφίτη
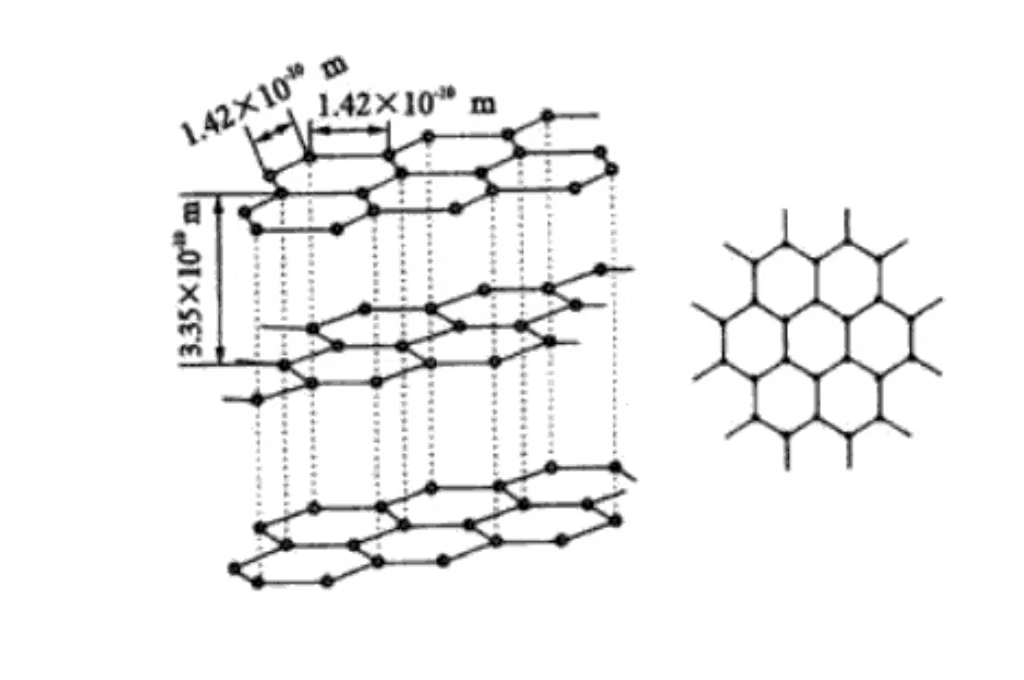
Σε μοριακό επίπεδο, ο γραφίτης αποτελείται από στρώματα από άτομα άνθρακα στοιβαγμένα το ένα πάνω στο άλλο. Τα άτομα άνθρακα μεταξύ των στρωμάτων διατηρούνται με σχετικά ασθενείς δυνάμεις van der Waals. Και αυτή η στρωματοποιημένη δομή εξηγεί γιατί ο γραφίτης έχει εξαιρετική λιπαντικότητα και εύκολη ολίσθηση μεταξύ των στρωμάτων.
Δύο βασικά στοιχεία της δομής του γραφίτη
Εξαγωνική κρυσταλλική δομή γραφίτη
Διακανονισμοί
Ο γραφίτης έχει εξαγωνική κρυσταλλική δομή, τα άτομα άνθρακα είναι στενά διατεταγμένα σε εξάγωνα στο επίπεδο, συμπεριλαμβανομένης μιας γωνίας 120 μοιρών. Η διάταξη είναι κανονική και σταθερή, ευνοεί την αγωγιμότητα των ηλεκτρονίων, είναι η βάση της καλής ηλεκτρικής αγωγιμότητάς του.
Layering
Τα άτομα άνθρακα στοιβάζονται σε παράλληλα επίπεδα, η απόσταση μεταξύ των στρωμάτων είναι περίπου 0,335 nm. Και η δύναμη van der Waals μεταξύ των στρωμάτων είναι ασθενής, γεγονός που καθιστά τον γραφίτη εύκολο να ολισθαίνει μεταξύ των εξωτερικών στρωμάτων και έχει λιπαντική ικανότητα. Αυτό χρησιμοποιείται συνήθως ως λιπαντικό στον τομέα της μηχανικής κατασκευής.
Στρώματα κρυσταλλικής δομής
Κάθε στρώμα ατόμων άνθρακα σχηματίζει ένα επίπεδο δικτύου μέσω ομοιοπολικών δεσμών. Αυτό διατάσσεται με τάξη στο χώρο, δίνοντας τα μακροσκοπικά κρυσταλλικά χαρακτηριστικά και την ανισοτροπία του γραφίτη. Ο ισχυρός ομοιοπολικός δεσμός στο στρώμα κάνει τον γραφίτη να έχει υψηλή αντοχή και σκληρότητα στο επίπεδο. Η κατακόρυφη διεύθυνση του επιπέδου έχει χαμηλή αντοχή λόγω της ασθενούς δύναμης μεταξύ των στρωμάτων.
Δεσμοί εντός ατόμων άνθρακα
Δυνάμεις Van der Waal
Τα άτομα άνθρακα μεταξύ των στρωμάτων βασίζονται στη δύναμη van der Waals, η οποία είναι ασθενής, με αποτέλεσμα τον εύκολο διαχωρισμό ολίσθησης μεταξύ των στρωμάτων γραφίτη και τη λιπαντικότητα. Αλλά καθιστά επίσης τη δομή μεταξύ των στρωμάτων του γραφίτη μεταβλητή υπό ορισμένες συνθήκες (όπως υψηλή θερμοκρασία και πίεση). Όπως μπορεί να μετατραπεί σε δομή διαμαντιού.
Διαχωρισμός στρωμάτων
Λόγω της ασθενούς δύναμης van der Waals, το στρώμα γραφίτη μπορεί να διαχωριστεί με την εφαρμογή μιας μικρής διατμητικής δύναμης. Αυτό δεν αντανακλά μόνο τη λιπαντικότητα, αλλά δημιουργεί επίσης τη δυνατότητα αντιδράσεων παρεμβολής, μέσω των οποίων μπορούν να αλλάξουν οι φυσικές και χημικές ιδιότητες του γραφίτη για την παρασκευή ειδικών σύνθετων υλικών. Όπως υλικά αρνητικών ηλεκτροδίων για μπαταρίες ιόντων λιθίου.
Ομοιοπολικοί δεσμοί
Τα άτομα άνθρακα στο στρώμα συνδέονται στενά με ομοιοπολικούς δεσμούς για να σχηματίσουν μια σταθερή εξαγωνική δομή. Αυτό καθορίζει την υψηλή σκληρότητα και αντοχή του γραφίτη στο επίπεδο, εγγυάται τη δομική του σταθερότητα στην εφαρμογή υλικών ηλεκτροδίων. Και περιορίζει την κίνηση των ηλεκτρονίων, επηρεάζοντας την ανισοτροπία στο επίπεδο.
Υβριδισμός Sp2
Γωνία πρόσδεσης
Τα άτομα άνθρακα υιοθετούν υβριδισμό sp2, ένα τροχιακό 2s και δύο τροχιακά 2p υβριδίζονται για να σχηματίσουν τρία ισοδύναμα τροχιακά υβριδισμού sp2. Αυτά κατανέμονται σε ένα επίπεδο τρίγωνο με γωνία περίπου 120 μοιρών. Έτσι, τα άτομα άνθρακα σχηματίζουν σταθερούς ομοιοπολικούς δεσμούς με τρία γειτονικά άτομα άνθρακα για να δημιουργήσουν μια εξαγωνική δομή, η οποία ευνοεί την αγωγιμότητα αποεστίασης ηλεκτρονίων και την καλή ηλεκτρική αγωγιμότητα.
Άτομα άνθρακα
Το άτομο άνθρακα κατασκευάζει έναν επίπεδο σκελετό με τρία άτομα άνθρακα που το περιβάλλουν μέσω υβριδικών τροχιακών sp2. Και τα κατακόρυφα επίπεδα των μη υβριδικών τροχιακών 2p επικαλύπτονται για να σχηματίσουν αποκεντρωμένα νέφη π-ηλεκτρονίων. Τα νέφη π-ηλεκτρονίων προσδίδουν στον γραφίτη καλή ηλεκτρική αγωγιμότητα, στην οποία τα ηλεκτρόνια μπορούν να κινούνται ελεύθερα σε απόκριση στις μεταβολές των ηλεκτρικών πεδίων. Και καθιστούν τον γραφίτη ενεργό σε χημικές αντιδράσεις και συμμετέχουν σε ηλεκτροχημικές διεργασίες. Όπως ως μέσο μεταφοράς ηλεκτρονίων στις μπαταρίες ιόντων λιθίου.
Ανισοτροπία
Χαρακτηριστικά εντός και εκτός επιπέδου
Ο γραφίτης παρουσιάζει σημαντική ανισοτροπία σε διάφορες κατευθύνσεις. Στο επίπεδο, ο ομοιοπολικός δεσμός είναι ισχυρός, με υψηλή σκληρότητα, αντοχή και καλή ηλεκτρική αγωγιμότητα. Όπως μπορείτε να χρησιμοποιήσετε σύνθετα υλικά ενισχυμένα με ίνες γραφίτη ως φάση ενίσχυσης για να χρησιμοποιήσετε την αντοχή του σε εφελκυσμό στο επίπεδο. Στην κατακόρυφη διεύθυνση του επιπέδου, λόγω της ασθενούς δύναμης van der Waals μεταξύ των στρωμάτων, χαμηλή αντοχή και κακή αγωγιμότητα. Αυτό το χαρακτηριστικό το κάνει να παίζει ένα στοχευμένο πλεονέκτημα σε διάφορα σενάρια εφαρμογών.
Ρυθμίσεις για την ατομική ενέργεια
Τα άτομα άνθρακα του γραφίτη διατάσσονται σύμφωνα με έναν συγκεκριμένο νόμο, σχηματίζοντας εξάγωνα στο επίπεδο και στοιβαζόμενα στρώματα στο χώρο. Η διάταξη αυτή καθορίζει την κρυσταλλική δομή και τις φυσικές και χημικές ιδιότητες. Η περίθλαση ακτίνων Χ μπορεί να προσδιορίσει την κρυσταλλικότητα και τις δομικές παραμέτρους σύμφωνα με το συγκεκριμένο μοτίβο που παρουσιάζει η διατεταγμένη διάταξη. Και η σταθερότητα της ατομικής διάταξης κάνει τον γραφίτη να διατηρεί σταθερή απόδοση σε ένα ορισμένο εύρος θερμοκρασιών και πιέσεων. Όπως ο γραφίτης ως πυρίμαχο υλικό σε υψηλή θερμοκρασία μπορεί να εξασφαλίσει την ακεραιότητα της δομής, παρέχοντας προστασία για την αξιοπιστία των βιομηχανικών εφαρμογών.
Πλέγμα και κρυσταλλική δομή του γραφίτη
Δομή πλέγματος του γραφίτη
Ο γραφίτης έχει εξαγωνική δομή πλέγματος, οι άξονες α και β είναι ίσου μήκους. Και η γωνία είναι 120 μοίρες, ο άξονας γ είναι κάθετος στο επίπεδο του ατόμου του άνθρακα. Το μήκος του αντικατοπτρίζει την περιοδική διάταξη της δομής των στρωμάτων, ανήκει στο εξαγωνικό κρυσταλλικό σύστημα, με συγκεκριμένη συμμετρία και κρυσταλλογραφικά χαρακτηριστικά.
Κρυσταλλική δομή γραφίτη
Ο κρύσταλλος του γραφίτη αποτελείται από πολυάριθμες εξαγωνικές μονάδες πλέγματος τοποθετημένες με τάξη στο χώρο. Και τα εσωτερικά άτομα άνθρακα είναι διατεταγμένα κατά τρόπο ιδιαίτερα διατεταγμένο. Και οι ατέλειες και οι προσμίξεις του θα αλλάξουν σημαντικά την απόδοσή του, επηρεάζοντας τη μεταφορά ηλεκτρονίων και φωνονίων, τις χημικές αντιδράσεις και την ομοιομορφία του υλικού.
Τρία κοινά ελαττώματα στη δομή του γραφίτη
Οι ατέλειες στη δομή του γραφίτη έχουν μεγάλη επίδραση στην απόδοσή του.
Οι σημειακές ατέλειες, όπως τα κενά και τα άτομα κενών θέσεων, θα καταστρέψουν την ατομική ακεραιότητα και θα επηρεάσουν την αγωγιμότητα των ηλεκτρονίων και τις μηχανικές ιδιότητες.
Οι γραμμικές ατέλειες, όπως η εξάρθρωση, επηρεάζουν την πλαστική παραμόρφωση και την αντοχή.
Οι επιφανειακές ατέλειες, όπως τα όρια των κόκκων, εμποδίζουν τη μετάδοση των ηλεκτρονίων και των φωνονίων, μειώνουν την αγωγιμότητα και τη θερμική αγωγιμότητα. Και οδηγούν εύκολα σε χημικές αντιδράσεις και συσσωμάτωση προσμίξεων.
Έννοιες σχετικές με τη δομή του γραφίτη
Δομή Lewis του γραφίτη
Η δομή Lewis του γραφίτη δείχνει τον διαμοιρασμό των ηλεκτρονίων μεταξύ των ατόμων άνθρακα και ικανοποιεί τη σταθερή δομή των οκτώ ηλεκτρονίων σχηματίζοντας ομοιοπολικούς δεσμούς με τα γειτονικά άτομα άνθρακα. Τα μη εμπλεκόμενα ηλεκτρόνια σχηματίζουν αποκεντρωμένα νέφη ηλεκτρονίων π. Αυτό παρέχει τη βάση για την κατανόηση του χημικού δεσμού και της κατανομής των ηλεκτρονίων.
Υβριδισμός γραφίτη
Ο υβριδισμός sp2 των ατόμων άνθρακα του γραφίτη είναι η ρίζα της μοναδικής δομής και των ιδιοτήτων του. Αυτό έχει ως αποτέλεσμα μια επίπεδη δομή, αποεστιασμένο νέφος π-ηλεκτρονίων, που προσδίδει στον γραφίτη μια ποικιλία εξαιρετικών ιδιοτήτων.
Σύμβολα και τύποι γραφίτη
Το χημικό σύμβολο του γραφίτη είναι "C". Αν και είναι δύσκολο να εκφραστεί η μακρομοριακή δομή με έναν απλό μοριακό τύπο, αλλά στον χημικό υπολογισμό και στον τύπο αντίδρασης. Το "C" μπορεί να αντιπροσωπεύει την αντίδραση του γραφίτη, αντικατοπτρίζοντας τη μετατροπή και τη διατήρηση του άνθρακα.
Δομή και δεσμοί γραφίτη
Η στρωματοποιημένη δομή και οι επιφανειακές ιδιότητες του γραφίτη έχουν μεγάλη σημασία για τις ιδιότητες συγκόλλησής του. Η δύναμη van der Waals μεταξύ των στρώσεων είναι ασθενής, επομένως είναι απαραίτητο να τροποποιηθεί η επιφάνεια του γραφίτη ή να επιλεγεί κατάλληλο συνδετικό υλικό για την ενίσχυση της αλληλεπίδρασης. Η τροποποίηση της επιφάνειας μπορεί να εισάγει λειτουργικές ομάδες ή επεξεργασία κοκκοποίησης. Και οι πολικές ομάδες του συνδετικού υλικού μπορούν να συνδεθούν ισχυρά με τα άτομα άνθρακα στην επιφάνεια του γραφίτη. Στα σύνθετα υλικά, η καλή απόδοση σύνδεσης είναι το κλειδί για την εγγύηση των συνολικών μηχανικών και λειτουργικών ιδιοτήτων. Και η κακή συγκόλληση είναι εύκολο να προκαλέσει συγκέντρωση διεπιφανειακών τάσεων, με αποτέλεσμα την αστοχία του υλικού.
Εξηγήστε τη δομή του γραφίτη και άλλων υλικών Διαφορά
Δομή γραφίτη έναντι δομής γραφενίου
Στην πραγματικότητα, γραφένιο αντιπροσωπεύει ένα στρώμα γραφίτη πάχους ενός ατόμου. Σε κάθε φύλλο γραφίτη πάχους 1 χιλιοστού υπάρχουν περίπου 3 εκατομμύρια στρώματα γραφενίου στοιβαγμένα το ένα πάνω στο άλλο. Το γραφένιο μπορεί να θεωρηθεί ως ένα στρώμα γραφίτη, ενώ ο γραφίτης αποτελείται από πολλά στρώματα γραφενίου το ένα πάνω στο άλλο.
Σύγκριση της δομής του γραφίτη και του διαμαντιού
Διαρθρωτικές διαφορές
Τα άτομα άνθρακα του διαμαντιού υιοθετούν υβριδισμό sp3 για να σχηματίσουν τετραεδρική δομή χώρου και οι ομοιοπολικοί δεσμοί μεταξύ των ατόμων είναι πολύ ισχυροί. Ο γραφίτης είναι sp2 υβριδικός επίπεδος εξαγωνικός και στρωματοποιημένος, με ασθενείς δυνάμεις van der Waals μεταξύ των στρωμάτων.
Διαφορές επιδόσεων
Οι διαρθρωτικές διαφορές οδηγούν σε ευδιάκριτες διαφορές επιδόσεων. Ο γραφίτης έχει μαλακή υφή, καλή λιπαντικότητα, χρησιμοποιείται ως λιπαντικό και μολύβι μολυβιού. Ο γραφίτης άγει τον ηλεκτρισμό, το διαμάντι δύσκολα. Το διαμάντι έχει υψηλό δείκτη διάθλασης και διαφάνεια, χρησιμοποιείται στα κοσμήματα- ο γραφίτης είναι μαύρος και αδιαφανής.
Τύποι δομής γραφίτη
Φυσικός γραφίτης
Συνήθως εμφανίζεται σε σχιστόλιθο γραφίτη, γνεύσιο γραφίτη, σχιστόλιθο που περιέχει γραφίτη και μεταμορφωμένο σχιστόλιθο. Σύμφωνα με την κρυσταλλική μορφή, φυσικός γραφίτης μπορεί ταυτόχρονα να χωριστεί σε δύο ποικιλίες: κρυσταλλικός γραφίτης - ο οποίος διακρίνεται περαιτέρω σε γραφίτη σε νιφάδες και κρυπτοκρυσταλλικός γραφίτης, γνωστός και ως γαιώδης γραφίτης.
Συνθετικός γραφίτης
Συνθετικός γραφίτης είναι ένα είδος χημικού προϊόντος. Το κύριο συστατικό του είναι ο άνθρακας. Λαμβάνεται μέσω πυρόλυσης και γραφίτωσης οργανικών πολυμερών σε υψηλή θερμοκρασία.
Ειδικές δομές γραφίτη, όπως ο διογκούμενος γραφίτης και οι δομές νανογραφίτη. Ο επεκτάσιμος γραφίτης με ειδική επεξεργασία, υλικό παρεμβολής ενδιάμεσου στρώματος, αποσύνθεση και επέκταση σε υψηλή θερμοκρασία, με καλό επιβραδυντικό φλόγας, χρησιμοποιείται για πυρίμαχα υλικά. Οι δομές νανογραφίτη, όπως τα φύλλα νανογραφίτη και οι ίνες νανογραφίτη, έχουν μεγάλη ειδική επιφάνεια, υψηλή επιφανειακή δραστηριότητα και εξαιρετικές μηχανικές ιδιότητες. Και έχει μεγάλες δυνατότητες στους τομείς της αποθήκευσης ενέργειας, των φορέων καταλυτών και των σύνθετων υλικών υψηλής απόδοσης.
Συσχέτιση μεταξύ δομής γραφίτη και χρήσης
Η μοναδική δομή του γραφίτη καθορίζει την ευρεία χρήση του. Η καλή ηλεκτρική αγωγιμότητα τον καθιστά υλικό ηλεκτροδίων, το οποίο χρησιμοποιείται σε μπαταρίες και ηλεκτρολυτικές κυψέλες. Η υψηλή σταθερότητα στη θερμοκρασία και η χημική αδράνεια τον καθιστούν πυρίμαχο υλικό για τη βιομηχανία χάλυβα. Η λιπαντική ικανότητα του επιτρέπει να δρα ως λιπαντικό στην κατασκευή μηχανημάτων. Στον τομέα της αεροδιαστημικής, τα σύνθετα υλικά γραφίτη χρησιμοποιούνται στην κατασκευή εξαρτημάτων αεροσκαφών και πυραύλων λόγω της χαμηλής πυκνότητας, της υψηλής αντοχής και της θερμικής σταθερότητας. Επιπλέον, ο γραφίτης παίζει επίσης σημαντικό ρόλο στην κατασκευή μολυβιών, στην παρασκευή γραφενίου και σε άλλους τομείς. Και κάθε εφαρμογή συνδέεται στενά με τη δομή του γραφίτη.
Συμπέρασμα
Η δομή του γραφίτη παρουσιάζει τη μοναδικότητα και την πολυπλοκότητά του από πολλαπλές διαστάσεις, γεγονός που επηρεάζει βαθύτατα την απόδοση και την εφαρμογή του. Η σε βάθος έρευνα και κατανόηση της δομής του γραφίτη ανοίγει ευρείες προοπτικές για την καινοτόμο εφαρμογή του σε πολλούς τομείς, όπως η επιστήμη των υλικών και η ενέργεια. Και αυτό συμβάλλει στην αντιμετώπιση των υλικών και ενεργειακών προβλημάτων της σύγχρονης κοινωνίας.