يلعب الجرافيت، باعتباره متآصلًا رئيسيًا للكربون، دورًا مهمًا في العديد من المجالات. ويُعد الاستكشاف المتعمق لهيكله هو المفتاح لفتح إمكانات التطبيق الواسعة للجرافيت وتطوير مواد جديدة.
جدول المحتويات
تبديل
ما هو الجرافيت؟
الجرافيت، وهو معدن مصنوع من ذرات الكربون، منتشر على نطاق واسع في الطبيعة. وله بريق معدني وملمس ناعم وسلس. وهذا يجعله مادة مثالية لأقلام الرصاص. ويكون لون الجرافيت في الغالب أسود أو رمادي داكن. وتختلف درجة نقاوته ودرجة تبلوره باختلاف بيئة التكوين.
التركيب الذري والجزيئي للجرافيت
التركيب الذري للجرافيت
المكون الرئيسي للجرافيت هو الكربون. ترتبط ذرات الكربون في الجرافيت بروابط تساهمية. وتشكل كل ذرة كربون وذرات الكربون الثلاث المحيطة بها بنية حلقة سداسية مستقرة تمتد بشكل غير محدد في المستوى لتشكل هيكلاً ذرياً صلباً.
التركيب الجزيئي للجرافيت
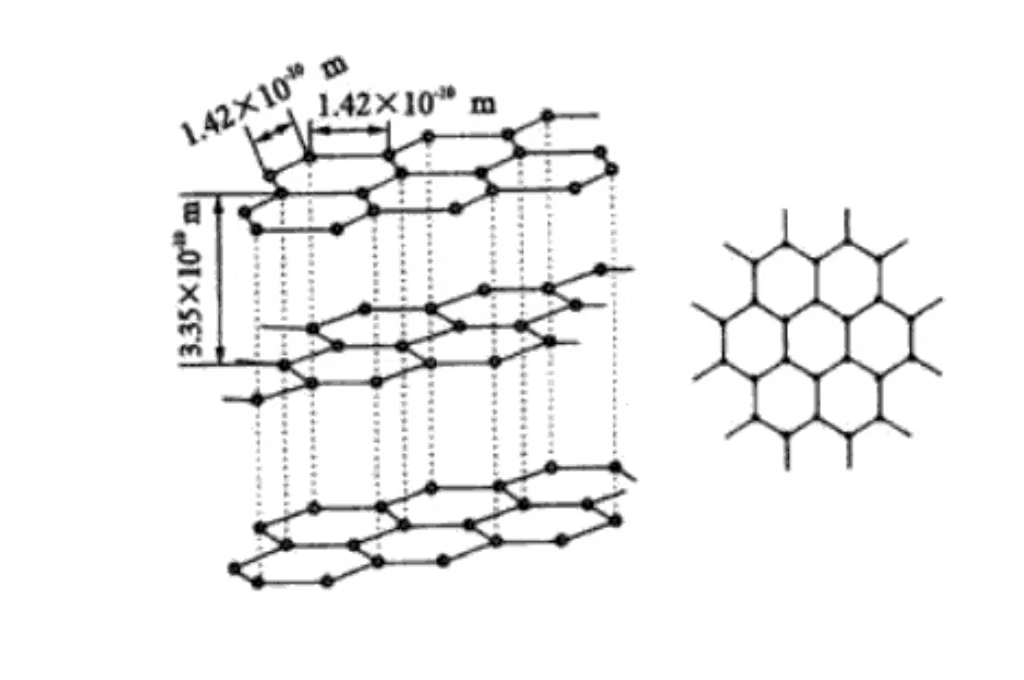
على المستوى الجزيئي، يتكون الجرافيت من الطبقات من ذرات الكربون المكدسة فوق بعضها البعض. ويتم الحفاظ على ذرات الكربون بين الطبقات بواسطة قوى فان دير فال الضعيفة نسبيًا. وتفسر هذه البنية الطبقية سبب التزليق الممتاز للجرافيت وسهولة الانزلاق بين الطبقات.
عنصران أساسيان في بنية الجرافيت
التركيب البلوري السداسي الجرافيت
الترتيبات
يحتوي الجرافيت على بنية بلورية سداسية الشكل، حيث يتم ترتيب ذرات الكربون بشكل متقارب في أشكال سداسية في المستوى، بما في ذلك زاوية 120 درجة. هذا الترتيب منتظم ومستقر، ويساعد على توصيل الإلكترونات، وهو أساس التوصيل الكهربائي الجيد.
الطبقات
يتم تكديس ذرات الكربون في مستويات متوازية، وتبلغ المسافة بين الطبقات حوالي 0.335 نانومتر. وتكون قوة فان دير فال بين الطبقات ضعيفة، مما يجعل الجرافيت سهل الانزلاق بين الطبقات الخارجية ويتميز بقابلية التشحيم. ويُستخدم عادةً كمادة تشحيم في مجال التصنيع الميكانيكي.
طبقات التركيب البلوري
تشكل كل طبقة من ذرات الكربون مستوى شبكي من خلال الروابط التساهمية. ويتم ترتيبها بطريقة منظمة في الفضاء، مما يعطي الخصائص البلورية العيانية وتباين الخواص في الجرافيت. تجعل الرابطة التساهمية القوية في الطبقة الجرافيت يتمتع بقوة وصلابة عالية في المستوى. أما الاتجاه المستوي الرأسي المستوي فيتميز بقوة منخفضة بسبب ضعف القوة البينية بين الطبقات.
الروابط داخل ذرات الكربون
قوات فان دير وال
تعتمد ذرات الكربون بين الطبقات البينية على قوة فان دير فال، وهي قوة ضعيفة، مما يؤدي إلى سهولة الفصل الانزلاقي بين طبقات الجرافيت والتشحيم. لكنه أيضًا يجعل البنية البينية لطبقات الجرافيت متغيرة في ظل ظروف معينة (مثل ارتفاع درجة الحرارة والضغط). مثل إمكانية تحوله إلى بنية ماسية.
فصل الطبقات
نظرًا لقوة فان دير فال الضعيفة، يمكن فصل طبقة الجرافيت عن طريق تطبيق قوة قص صغيرة. وهذا لا يعكس التزييت فحسب، بل يخلق أيضًا إمكانية حدوث تفاعلات إقحام، يمكن من خلالها تغيير الخصائص الفيزيائية والكيميائية للجرافيت لإعداد مواد مركبة خاصة. مثل مواد القطب السالب لبطاريات الليثيوم أيون.
الروابط التساهمية
ترتبط ذرات الكربون في الطبقة بإحكام بواسطة روابط تساهمية لتشكيل بنية سداسية مستقرة. وهذا ما يحدد الصلابة والقوة العالية للجرافيت في المستوى، ويضمن استقراره الهيكلي في تطبيق مواد الأقطاب الكهربائية. ويحد من حركة الإلكترونات، مما يؤثر على التباين في المستوى.
تهجين Sp2
زاوية السند
تتبنى ذرات الكربون تهجين sp2، حيث تتهجين ذرة 2s ومداران 2p لتكوين ثلاثة مدارات تهجين sp2 مكافئة. وتتوزع هذه المدارات في مثلث مستوٍ بزاوية 120 درجة تقريبًا. بحيث تشكل ذرات الكربون روابط تساهمية مستقرة مع ثلاث ذرات كربون متجاورة لبناء بنية سداسية الشكل، وهو ما يساعد على توصيل عدم تمركز الإلكترونات وتوصيل كهربائي جيد.
ذرات الكربون
تبني ذرة الكربون هيكلًا مستوٍ مع ثلاث ذرات كربون محيطة بها من خلال المدارات الهجينة sp2. وتتداخل المستويات الرأسية لمدارات 2p غير المهجنة لتكوين سحب π-إلكترونية غير متمركزة. وتمنح السحب π-إلكترونية الجرافيت توصيلية كهربائية جيدة، حيث يمكن للإلكترونات أن تتحرك بحرية استجابة للتغيرات في المجالات الكهربائية. وتجعل الجرافيت نشطًا في التفاعلات الكيميائية والمشاركة في العمليات الكهروكيميائية. مثل وسيط نقل الإلكترونات في بطاريات أيونات الليثيوم.
التباين الخواص
السمات داخل المستوى والسمات خارج المستوى
يُظهر الجرافيت تباينًا كبيرًا في اتجاهات مختلفة. في المستوى، تكون الرابطة التساهمية قوية، مع صلابة عالية وقوة وتوصيل كهربائي جيد. مثل يمكنك استخدام المواد المركبة المقواة بألياف الجرافيت كمرحلة تقوية لاستخدام قوة الشد في المستوى. في اتجاه المستوى العمودي، بسبب قوة فان دير فال الضعيفة بين الطبقات، والقوة المنخفضة والموصلية الضعيفة. هذه الخاصية تجعلها تلعب ميزة مستهدفة في سيناريوهات التطبيق المختلفة.
ترتيبات الطاقة الذرية
يتم ترتيب ذرات الكربون الجرافيت وفقًا لقانون معين، حيث تشكل ذرات الكربون الجرافيت سداسية الشكل في المستوى وطبقات التراص في الفضاء. ويحدد هذا الترتيب البنية البلورية والخصائص الفيزيائية والكيميائية. ويمكن أن يحدد حيود الأشعة السينية التبلور والبارامترات التركيبية وفقًا للنمط المحدد الذي يقدمه الترتيب المرتب. كما أن ثبات الترتيب الذري يجعل الجرافيت يحافظ على أداء مستقر في نطاق درجة حرارة وضغط معين. مثل الجرافيت كمادة حرارية في درجة حرارة عالية يمكن أن يضمن سلامة الهيكل، مما يوفر الحماية لموثوقية التطبيقات الصناعية.
الشبيكة والتركيب البلوري للجرافيت
التركيب الشبكي للجرافيت
يحتوي الجرافيت على بنية شبكية سداسية الشكل، والمحور a والمحور b متساويان في الطول. والزاوية 120 درجة، والمحور c عمودي على مستوى ذرة الكربون. ويعكس طولها الترتيب الدوري للبنية الطبقية، وهي تنتمي إلى النظام البلوري السداسي الأضلاع، مع تناظر وخصائص بلورية محددة.
التركيب البلوري للجرافيت
تتكون بلورة الجرافيت من وحدات شبكية سداسية عديدة مرتبة بطريقة منظمة في الفضاء. ويتم ترتيب ذرات الكربون الداخلية بطريقة منظمة للغاية. وتؤدي العيوب والشوائب إلى تغيير أدائها بشكل كبير، مما يؤثر على نقل الإلكترون والفونون والتفاعلات الكيميائية وتوحيد المادة.
ثلاثة عيوب شائعة في بنية الجرافيت
للعيوب في بنية الجرافيت تأثير كبير على أدائه.
ستدمر العيوب النقطية، مثل العيوب النقطية، مثل الذرات الشاغرة والخلو من الذرات، السلامة الذرية وتؤثر على توصيل الإلكترونات والخواص الميكانيكية.
تؤثر العيوب الخطية مثل الخلع على التشوه البلاستيكي والقوة.
وتعيق العيوب السطحية، مثل الحدود الحبيبية انتقال الإلكترونات والفونونات وتقلل من التوصيلية والتوصيلية الحرارية. وتؤدي بسهولة إلى تفاعلات كيميائية وتجمع الشوائب.
المفاهيم المتعلقة ببنية الجرافيت
بنية لويس الجرافيت الجرافيت
تُظهِر بنية لويس للجرافيت مشاركة الإلكترونات بين ذرات الكربون، وتحقق البنية المستقرة ذات الثمانية إلكترونات من خلال تكوين روابط تساهمية مع ذرات الكربون المجاورة. وتُشكِّل الإلكترونات غير المتشاركة سُحُبًا إلكترونية غير متمركزة. وهذا يوفر الأساس لفهم الترابط الكيميائي وتوزيع الإلكترونات.
تهجين الجرافيت
ويُعد تهجين ذرات الكربون الجرافيت sp2 أساس بنيته وخصائصه الفريدة. وينتج عن ذلك بنية مستوية وسحابة إلكترونية غير متمركزة π-إلكترونية، مما يمنح الجرافيت مجموعة متنوعة من الخصائص الممتازة.
رموز وصيغ الجرافيت
الرمز الكيميائي للجرافيت هو "C". على الرغم من أنه من الصعب التعبير عن التركيب الجزيئي الكبير بصيغة جزيئية بسيطة، ولكن في الحساب الكيميائي وصيغة التفاعل. يمكن أن يمثل "C" تفاعل الجرافيت، مما يعكس تحول الكربون وحفظه.
بنية الجرافيت وترابط الجرافيت
تُعد بنية الطبقات وخصائص سطح الجرافيت ذات أهمية كبيرة لخصائص الترابط. إن قوة فان دير فال البينية ضعيفة، لذلك من الضروري تعديل سطح الجرافيت أو اختيار مادة رابطة مناسبة لتعزيز التفاعل. ويمكن أن يؤدي تعديل السطح إلى إدخال مجموعات وظيفية أو معالجة الخشونة. ويمكن للمجموعات القطبية للمادة الرابطة أن ترتبط بقوة مع ذرات الكربون على سطح الجرافيت. في المواد المركبة، يعتبر أداء الترابط الجيد هو المفتاح لضمان الخصائص الميكانيكية والوظيفية الكلية. ومن السهل أن يتسبب الترابط الضعيف في تركيز الإجهاد البيني، مما يؤدي إلى فشل المواد.
شرح تركيب الجرافيت والمواد الأخرى المختلف عليها
هيكل الجرافيت مقابل هيكل الجرافين
في الواقع الجرافين يمثل طبقة سمكها ذرة واحدة من الجرافيت. في كل صفيحة من الجرافيت بسماكة 1 مم، يوجد حوالي 3 ملايين طبقة من الجرافين مكدسة فوق بعضها البعض. يمكن اعتبار الجرافين طبقة واحدة من الجرافيت بينما يتكون الجرافيت من عدة طبقات من الجرافين فوق بعضها البعض.
مقارنة بين هيكل الجرافيت والماس
الاختلافات الهيكلية
تعتمد ذرات الكربون في الماس على تهجين sp3 لتكوين بنية فضائية رباعية الأوجه، وتكون الروابط التساهمية بين الذرات قوية للغاية. أما الجرافيت فهو سداسي سداسي مستوٍ هجين sp2 ومكوّن من طبقات، مع وجود قوى فان دير فال ضعيفة بين الطبقات.
فروق الأداء
تؤدي الاختلافات الهيكلية إلى اختلافات واضحة في الأداء. صلابة الماس عالية جدًا، ويستخدم في التصنيع الآلي؛ الجرافيت ناعم الملمس، جيد التشحيم، ويستخدم كمواد تشحيم ورصاص رصاصي. الجرافيت موصل للكهرباء، والماس بالكاد. الماس ذو معامل انكسار وشفافية عالية، ويستخدم في المجوهرات؛ الجرافيت أسود وغير شفاف.
أنواع بنية الجرافيت
جرافيت طبيعي
ويحدث عادةً في شست الجرافيت والنيس الجرافيت والشست الحامل للجرافيت والصخر الصخري المتحول. وفقاً للشكل البلوري, الجرافيت الطبيعي يمكن تقسيمها في نفس الوقت إلى نوعين: الجرافيت البلوري - والذي ينقسم أيضًا إلى جرافيت متقشر وجرافيت بلوري مشفر، والمعروف أيضًا باسم الجرافيت الترابي.
الجرافيت الصناعي
جرافيت اصطناعي هو نوع من المنتجات الكيميائية. مكونه الرئيسي هو الكربون. ويتم الحصول عليه من خلال الانحلال الحراري بدرجة حرارة عالية وجرافيتة البوليمرات العضوية.
هياكل الجرافيت الخاصة مثل الجرافيت القابل للتوسيع وهياكل النانوجرافيت. الجرافيت القابل للتوسيع عن طريق المعالجة الخاصة، مادة إدراج الطبقات البينية، والتحلل والتوسع في درجة حرارة عالية، مع مثبطات اللهب الجيدة، وتستخدم لمواد مقاومة للحريق. تتميز هياكل الجرافيت النانوية، مثل صفائح الجرافيت النانوية وألياف الجرافيت النانوية، بمساحة سطح محددة كبيرة ونشاط سطحي مرتفع وخصائص ميكانيكية ممتازة. ولها إمكانات كبيرة في مجالات تخزين الطاقة وحاملات المحفزات والمواد المركبة عالية الأداء.
العلاقة بين بنية الجرافيت والاستخدام
يحدد التركيب الفريد للجرافيت استخدامه على نطاق واسع. الموصلية الكهربائية الجيدة تجعله مادة قطب كهربائي تستخدم في البطاريات والخلايا الإلكتروليتية. ثباته في درجات الحرارة العالية وخموله الكيميائي يجعله مادة حرارية لصناعة الصلب. تمكنه قابلية التشحيم من العمل كمادة تشحيم في صناعة الآلات. في مجال الطيران، تُستخدم مركبات الجرافيت في صناعة مكونات الطائرات والصواريخ بسبب كثافتها المنخفضة وقوتها العالية وثباتها الحراري. بالإضافة إلى ذلك، يلعب الجرافيت أيضًا دورًا مهمًا في تصنيع أقلام الرصاص وتحضير الجرافين وغيرها من المجالات. ويرتبط كل تطبيق ارتباطًا وثيقًا ببنية الجرافيت.
الخاتمة
يُظهر هيكل الجرافيت تفرده وتعقيده من أبعاد متعددة، مما يؤثر بعمق على الأداء والتطبيق. ويفتح البحث والفهم المتعمق لبنية الجرافيت آفاقًا واسعة لتطبيقه المبتكر في العديد من المجالات مثل علوم المواد والطاقة. وهذا يساعد على التغلب على مشاكل المواد والطاقة في المجتمع الحديث.